БСЭ БСЭ - Большая Советская Энциклопедия (ФО)
- Название:Большая Советская Энциклопедия (ФО)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ФО) краткое содержание
Большая Советская Энциклопедия (ФО) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Физические свойства. Элементарный Ф. существует в виде нескольких аллотропических модификаций, главная из которых – белая, красная и чёрная. Белый Ф. – воскообразное, прозрачное вещество с характерным запахом, образуется при конденсации паров Ф. Белый Ф. в присутствии примесей – следов красного Ф., мышьяка, железа и т.п. – окрашен в жёлтый цвет, поэтому товарный белый Ф. называется жёлтым. Существуют две формы белого Ф.: a- и b-форма. a-модификация представляет собой кристаллы кубической системы ( а = 18,5 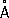 ); плотность 1,828 г/см 3 , t пл44,1 °С, t кип280,5 °C, теплота плавления 2,5 кдж/моль P 4(0,6 ккал/моль P 4), теплота испарения 58,6 кдж/моль Р 4(14,0 ккал/моль P 4) , давление пара при 25 °С 5,7 н/м 2 (0,043 мм рт. ст. ) . Коэффициент линейного расширения в интервале температур от 0 до 44 °С равен 12,4×10 -4 , теплопроводность 0,56 вт/ ( м ×К) [1,1346×10 -3 кал/ ( см × сек ×°С)] при 25 °С. По электрическим свойствам «белый Ф. близок к диэлектрикам: ширина запрещенной зоны около 2,1 эв, удельное электросопротивление 1,54×10 11 ом × см, диамагнитен, удельная магнитная восприимчивость – 0,86×10 -6. Твёрдость по Бринеллю 6 Мн/м 2 (0,6 кгс/мм 2 ) . a-форма белого Ф. хорошо растворяется в сероуглероде, хуже – в жидком аммиаке, бензоле, четырёххлористом углероде и др. При – 76,9 °С и давлении 0,1 Мн/м 2 (1 кгс/см 2 ) a-форма переходит в низкотемпературную b-форму (плотность 1,88 г/см 3 ) . С повышением давления до 1200 Мн/м 2 (12 тыс. кгс/см 2 ) переход происходит при 64,5 °С. b-форма – кристаллы с двойным лучепреломлением, их структура окончательно не установлена. Белый Ф. ядовит: на воздухе при температуре около 40 °С самовоспламеняется, поэтому его следует хранить под водой (растворимость в воде при 25 °С 3,3×10 -4%) . Нагреванием белого Ф. без доступа воздуха при 250–300 °С в течение нескольких часов получают красный Ф. Переход экзотермичен, ускоряется ультрафиолетовыми лучами, а также примесями (иод, натрий, селен). Обычный товарный красный Ф. практически полностью аморфен; имеет цвет от тёмно-коричневого до фиолетового. При длительном нагревании, необратимо может переходить в одну из кристаллических форм (триклинную, кубическую и др.) с различными свойствами: плотностью от 2,0 до 2,4 г/см 3 , t плот 585 до 610 °С при давлении в несколько десятков атмосфер, температурой возгонки от 416 до 423 °С, удельным электросопротивлением от 10 9до 10 14 ом × см. Красный Ф. на воздухе не самовоспламеняется; вплоть до температуры 240–250 °С, но самовоспламеняется при трении или ударе; нерастворим в воде, а также в бензоле, сероуглероде и др., растворим в трибромиде Ф. При температуре возгонки красный Ф. превращается в пар, при охлаждении которого образуется в основном белый Ф.
); плотность 1,828 г/см 3 , t пл44,1 °С, t кип280,5 °C, теплота плавления 2,5 кдж/моль P 4(0,6 ккал/моль P 4), теплота испарения 58,6 кдж/моль Р 4(14,0 ккал/моль P 4) , давление пара при 25 °С 5,7 н/м 2 (0,043 мм рт. ст. ) . Коэффициент линейного расширения в интервале температур от 0 до 44 °С равен 12,4×10 -4 , теплопроводность 0,56 вт/ ( м ×К) [1,1346×10 -3 кал/ ( см × сек ×°С)] при 25 °С. По электрическим свойствам «белый Ф. близок к диэлектрикам: ширина запрещенной зоны около 2,1 эв, удельное электросопротивление 1,54×10 11 ом × см, диамагнитен, удельная магнитная восприимчивость – 0,86×10 -6. Твёрдость по Бринеллю 6 Мн/м 2 (0,6 кгс/мм 2 ) . a-форма белого Ф. хорошо растворяется в сероуглероде, хуже – в жидком аммиаке, бензоле, четырёххлористом углероде и др. При – 76,9 °С и давлении 0,1 Мн/м 2 (1 кгс/см 2 ) a-форма переходит в низкотемпературную b-форму (плотность 1,88 г/см 3 ) . С повышением давления до 1200 Мн/м 2 (12 тыс. кгс/см 2 ) переход происходит при 64,5 °С. b-форма – кристаллы с двойным лучепреломлением, их структура окончательно не установлена. Белый Ф. ядовит: на воздухе при температуре около 40 °С самовоспламеняется, поэтому его следует хранить под водой (растворимость в воде при 25 °С 3,3×10 -4%) . Нагреванием белого Ф. без доступа воздуха при 250–300 °С в течение нескольких часов получают красный Ф. Переход экзотермичен, ускоряется ультрафиолетовыми лучами, а также примесями (иод, натрий, селен). Обычный товарный красный Ф. практически полностью аморфен; имеет цвет от тёмно-коричневого до фиолетового. При длительном нагревании, необратимо может переходить в одну из кристаллических форм (триклинную, кубическую и др.) с различными свойствами: плотностью от 2,0 до 2,4 г/см 3 , t плот 585 до 610 °С при давлении в несколько десятков атмосфер, температурой возгонки от 416 до 423 °С, удельным электросопротивлением от 10 9до 10 14 ом × см. Красный Ф. на воздухе не самовоспламеняется; вплоть до температуры 240–250 °С, но самовоспламеняется при трении или ударе; нерастворим в воде, а также в бензоле, сероуглероде и др., растворим в трибромиде Ф. При температуре возгонки красный Ф. превращается в пар, при охлаждении которого образуется в основном белый Ф.
При нагревании белого Ф. до 200–220 °С под давлением (1,2–1,7)×10 3 Мн/м 2 [(12–17)×10 3 кгс/см 2] образуется чёрный Ф. Это превращение можно осуществить без давления, но в присутствии ртути и небольшого количества кристаллов чёрного Ф. (затравки) при 370 °С в течение 8 сут. Чёрный Ф. представляет собой кристаллы ромбической структуры ( а = 3,31 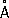 , b = 4,38
, b = 4,38 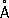 , с = 10,50
, с = 10,50 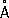 ), решётка построена из волокнистых слоев с характерным для Ф. пирамидальным расположением атомов, плотность 2,69 г/см 3, t плоколо 1000 °С под давлением 1,8×10 3 Мн/м 2 (18×10 3 кгс/см 2 ) . По внешнему виду чёрный Ф. похож на графит; полупроводник: ширина запрещенной зоны 0,33 эв при 25 °С; имеет удельное электросопротивление 1,5 ом × см, температурный коэффициент электросопротивления 0,0077, диамагнитен, удельная магнитная восприимчивость – 0,27×10 -6. При нагревании до 560–580 °С под давлением собственных паров превращается в красный Ф. Чёрный Ф. малоактивен, с трудом воспламеняется при поджигании, поэтому его можно безопасно подвергать механической обработке на воздухе.
), решётка построена из волокнистых слоев с характерным для Ф. пирамидальным расположением атомов, плотность 2,69 г/см 3, t плоколо 1000 °С под давлением 1,8×10 3 Мн/м 2 (18×10 3 кгс/см 2 ) . По внешнему виду чёрный Ф. похож на графит; полупроводник: ширина запрещенной зоны 0,33 эв при 25 °С; имеет удельное электросопротивление 1,5 ом × см, температурный коэффициент электросопротивления 0,0077, диамагнитен, удельная магнитная восприимчивость – 0,27×10 -6. При нагревании до 560–580 °С под давлением собственных паров превращается в красный Ф. Чёрный Ф. малоактивен, с трудом воспламеняется при поджигании, поэтому его можно безопасно подвергать механической обработке на воздухе.
Атомный радиус Ф. 1,34 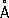 , ионные радиусы: P 5 +0,35
, ионные радиусы: P 5 +0,35 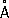 , P 3 +0,44
, P 3 +0,44 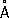 , P 3-1,86
, P 3-1,86 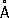 .
.
Атомы Ф. объединяются в двухатомные (P 2), четырёхатомные (P 4) и полимерные молекулы. Наиболее стабильны при нормальных условиях полимерные молекулы, содержащие длинные цепи связанных между собой P 4– тетраэдров. В жидком, твёрдом виде (белый Ф.) и в парах ниже 800 °С Ф. состоит из молекул P 4. При температурах выше 800 °С молекулы P 4диссоциируют на P 2 , которые, в свою очередь, распадаются на атомы при температуре свыше 2000 °С. Только белый Ф. состоит из молекул P 4, все остальные модификации – полимеры.
Химические свойства. Конфигурация внешних электронов атома Ф. 3 s 2 3 p 3, в соединениях наиболее характерны степени окисления + 5, + 3, и – 3. Подобно азоту, Ф. в соединениях главным образом ковалентен. Ионных соединений, подобных фосфидам Na 3P, Ca 3P 2, очень мало. В отличие от азота, Ф. обладает свободными 3 d -opбиталями с довольно низкими энергиями, что приводит к возможности увеличения координационного числа и образованию донорно-акцепторных связей.
Ф. химически активен, наибольшей активностью обладает белый Ф.; красный и чёрный Ф. в химических реакциях гораздо пассивнее. Окисление белого Ф. происходит по механизму цепных реакций. Окисление Ф. обычно сопровождается хемилюминесценцией. При горении Ф. в избытке кислорода образуется пятиокись P 4O 10(или P 2O 5), при недостатке – в основном трёхокись P 4O 6(или P 2O 3). Спектроскопически доказано существование в парах P 4O 7, P 4O 8 , P 2O 6, PO и др. фосфора окислов. Пятиокись Ф. получают в промышленных масштабах сжиганием элементарного Ф. в избытке сухого воздуха. Последующая гидратация P 4O 10приводит к получению орто- (Н 3РО 4) и поли- (Н n + 2 P n O 3 п + 1) фосфорных кислот. Кроме того, Ф. образует фосфористую кислоту H 3PO 3, фосфорноватую кислоту H 4P 2O 6и фосфорноватистую кислоту H 3PO 2, а также надкислоты: надфосфорную H 4P 2O 8и мононадфосфорную H 3PO 5Широкое применение находят соли фосфорных кислот ( фосфаты ) , в меньшей степени – фосфиты и гипофосфиты.
Ф. непосредственно соединяется со всеми галогенами с выделением большого количества тепла и образованием тригалогенидов (PX 3, где Х – галоген), пентагалогенидов (PX 5) и оксигалогенидов (например, POX 3) (см. Фосфора галогениды ) . При сплавлении Ф. с серой ниже 100 °С образуются твёрдые растворы на основе Ф. и серы, а выше 100 °С происходит экзотермическая реакция образования кристаллических сульфидов P 4S 3, P 4S 5, P 4S 7, P 4S 10, из которых только P 4S 5при нагревании выше 200 °С разлагается на P 4S 3и P 4S 7, а остальные плавятся без разложения. Известны оксисульфиды фосфора: P 2O 3S 2, P 2O 3S 3, P 4O 4S 3, P 6O 10S 5и P 4O 4S 3. Ф. по сравнению с азотом менее способен к образованию соединений с водородом. Фосфористый водород фосфин PH 3и дифосфин P 2H 4могут быть получены только косвенным путём. Из соединений Ф. с азотом известны нитриды PN, P 2N 3, P 3N 5– твёрдые, химически устойчивые вещества, полученные при пропускании азота с парами Ф. через электрическую дугу; полимерные фосфонитрилгалогениды – (PNX 2) n(например, полифосфонитрилхлорид ) , полученные взаимодействием пентагалогенидов с аммиаком при различных условиях; амидоимидофосфаты – соединения, как правило, полимерные, содержащие наряду с Р–О–Р связями Р–NH–Р связи.
Читать дальшеИнтервал:
Закладка:
