Сергей Москаленко - Уборка 4.0. Здания и сооружения
- Название:Уборка 4.0. Здания и сооружения
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2022
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Сергей Москаленко - Уборка 4.0. Здания и сооружения краткое содержание
Уборка 4.0. Здания и сооружения - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
• Применение (для концентратов указывают рекомендованную дозировку)
• Дополнительные маркировки (например, эко маркировки)

Разбираясь в содержании этикеток (в том числе, если она на иностранном языке) можно понять применение средства, даже если Вы его первый раз видите.
Состав моющих средств
Вода
Поверхностно-активные вещества (ПАВ)
Щелочи или кислоты
Комплексообразователи
Растворители
Дезинфицирующие компоненты
Другие компоненты (ингибиторы, абразивы, консерванты, масла, воски и т.д.)
Вода
является буфером, в котором происходит процесс очистки
– Доставляет компоненты моющих средств до загрязнения
– Удаляет верхний слой загрязнений и увлажняет поверхность
– Замачивает загрязнения, размягчая их
– Передает механическую энергию и ускоряет удаление загрязнений
– Удерживает загрязнения в виде суспензии
– Забирает загрязнения
– Является теплоносителем
– Снижает агрессивное воздействие моющих средств на поверхность
ВАЖНО!При недостаточном количестве воды процесс очистки может происходить значительно хуже
Поверхностно-активные вещества (ПАВ)
химические соединения, которые, концентрируясь на поверхности раздела термодинамических фаз, вызывают снижение поверхностного натяжения.
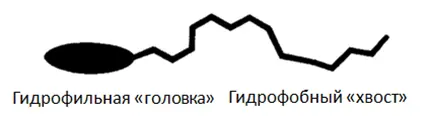
– Увеличивают смачиваемость поверхности (за счет уменьшения поверхностного натяжения воды)

– Эмульгируют жиры и масла
– Диспергируют твердые загрязнения и удерживают их в растворе
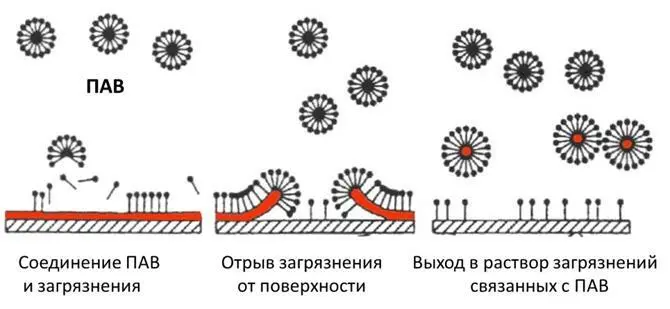
– Удерживают ухаживающие компоненты на поверхности
– Образуют пену
Водородный показатель pH
один из важнейших показателей свойств водных растворов. Он указывает на агрессивность раствора по отношению к веществам и материалам, его кислотность (щелочность). Изменяется в пределах от 0 до 14. рН =7 у нейтральной среды. Сила и агрессивность кислот увеличиваются с уменьшением рН, а щелочей – с увеличением.
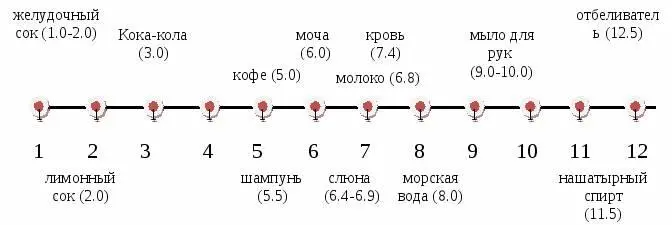
Изменение значения pH при разбавлении
Значение pH равно по модулю и противоположно по знаку десятичному логарифму активности водородных ионов, выраженной в молях на один литр: pH = -lg[H +]
В чистой нейтральной воде значение pH = 7,0 и концентрация ионов H +и ионов OH −обе равны 10 -7(0,0000001) моль/л.
Если pH = 5,0, то это означает, что концентрация ионов H += 10 -5(0,00001) моль/л.
При разбавлении в 10 раз, концентрация ионов H +станет равна 10 -6(0,000001) моль/л, следовательно, значение pH измениться на 1,0 и будет равно 6,0
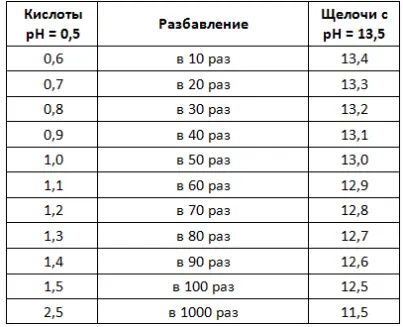
Чаще всего для ежедневной уборки используют средства в разведении 1:100, в этом случае значение pH у рабочего раствора будет смещено на 2 единицы в сторону 7,0 относительно значение pH концентрата (обычно указывается на этикетке).
Определение уровня pH
Лакмусовая бумага – это кислотно-основный индикатор, который в кислой среде приобретает красную окраску, а в щелочной – синюю

Фенолфталеин – кислотно-основный индикатор, изменяющий окраску от бесцветной (при pH < 8,2) до красно-фиолетовой, «малиновой» (в щелочной); но в концентрированной щелочи – бесцветен.
Щелочные средства– средства, растворы которых имеют рН>8. Щелочную реакцию раствору дают определенные компоненты – щелочи, щелочные соли, некоторые ПАВы.
Хорошо растворяют органические загрязнения (жиры, масла и так далее)
Используются на пищевой промышленности и в зоне приготовления пищи
Используются для проведения генеральных уборок
Используются для удаления полимерных защит (стриппинга)
На руках ощущается в виде мылкости
Щелочи – вещества, дающие в водном растворе ион гидроксила ОН¯
В моющих средствах применятся в основном гидроксид натрия (каустическая сода, каустик, NaOH), а также гидроксид калия (каустический поташ, КOH). Эти гидроксиды являются сильными основаниями и очень едкими. Из-за более высокой стоимости гидроксид калия применяется редко (например, в новом Ph Promline AL 01, остальные средства марки рН на гидроксиде натрия).
Щелочи активно реагируют с легкими металлами – алюминием, цинком, оловом. О реакции можно судить по выделению мелких пузырьков – водорода.
Цинк на объектах встречается в виде оцинкованного железа (после реакции защитный слой цинка растворяется, а железо начинает ржаветь) и сплавов типа латуни (после реакции желтая поверхность латуни краснеет – цинк из сплава вытравливается – т.е. растворяется).
Пищевым оловом часто покрываются латунные детали кофе-машин (после реакции поверхность желтеет – олово растворяется и на поверхность выступает желтая латунь, далее начнет краснеть по причинам, указанным выше).
Щелочные соли – вещества, дающие в ходе химической реакции с водой (реакция гидролиза) ион гидроксила ОН¯.
Пример реакции гидролиза:
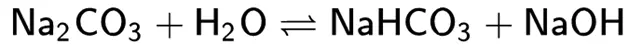
В моющих средствах играют роль создания щелочной среды – для более эффективного удаления ряда загрязнений. В отличие от щелочей не повреждают поверхности из цветных металлов (алюминий, оцинковка, латунь), а также многие (но не все!) чувствительные к щелочи поверхности.
ВАЖНО!При высоких концентрациях и высоких температурах начинают более активно гидролизоваться, соответственно выделяют больше гидроксида натрия и начинают вступать в реакцию с цветными металлами.
Применяются в основном следующие вещества (в порядке убывания активности):
– Метасиликат натрия (жидкое стекло, Na 2SiO 3) – самый распространенный щелочной компонент, применяется в средствах для удаления нагаров с алюминия (Ph Promline AL 04), средствах для мытья алюминиевой тары в посудомоечных машинах (Tana NOWA FLA), в мягких промышленных очистителях для цветных металлов и окрашенных поверхностей (Tana NOWA tanin).
Читать дальшеИнтервал:
Закладка:










