Павел Фельдман - Как создать стратегию работы с врачами. Практические советы
- Название:Как создать стратегию работы с врачами. Практические советы
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:9785449332615
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Павел Фельдман - Как создать стратегию работы с врачами. Практические советы краткое содержание
Как создать стратегию работы с врачами. Практические советы - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
3. Фармацевт должен предложить на выбор несколько МНН. Желательно в данном случае учитывать платежеспособность пациента, и от него требуется согласие. Далее: «Если у пациента нет предпочтений в выборе из нескольких ЛС с одинаковым составом, формой выпуска, дозировкой и незначительными различиями в цене, то приоритет отдается тому ЛС, которое пациент принимал ранее (при хроническом заболевании), либо препарату, который дольше других находится на фармацевтическом рынке и доказавшему свою эффективность и безопасность в повседневной практике» 10.
4. Замена аналогом, а не синонимом. Это вообще другая история, которая решается только врачом после звонка ему фармацевта. Вероятность такого события невелика и стремится к нулю – скорее всего, будет продано нечто аналогичное, и об индивидуализации назначенной терапии можно будет просто забыть.
С продвижением лекарственных средств государство тоже взяло ситуацию под контроль, и в 2011 году был принят Федеральный закон №323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации».
Его положения, регулирующие взаимодействие практикующих врачей с фармацевтическими компаниями (Статья 74), вступили в силу 1 января 2012 года. С этого момента руководители медицинских организаций и другие медицинские работники уже не могли принимать от сотрудников фармкомпаний деньги и подарки, участвовать в развлечениях за счет компаний, получать образцы препаратов для передачи пациентам, а также заключать соглашения о рекомендации и назначении любых лекарственных средств.
Возможности продвижения фармацевтических продуктов во время визитов медицинских представителей и сами визиты стали сильно ограничены. Далее – иллюстрации того, что можно, и что нельзя делать при продвижении рецептурного препарата и взаимодействии представителя компании с врачом и аптекой 9:
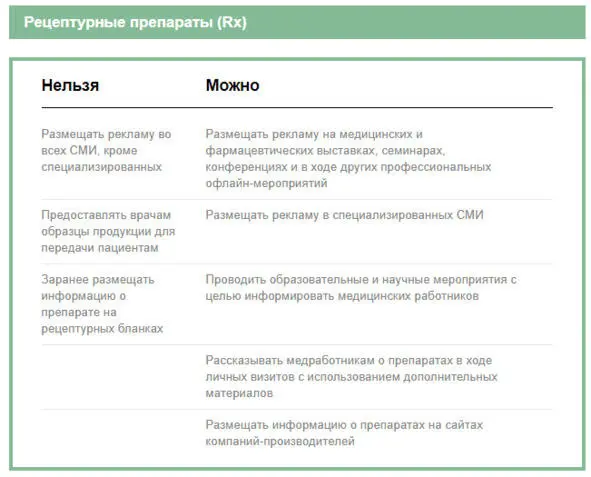

Правовое регулирование продвижения лекарственных средств выполняет три основные функции, направленные на обеспечение интересов потребителей и охрану их здоровья. Это – гарантия корректности, достоверности и полноты распространяемой информации; регламентация содержания способов продвижения; борьба с недобросовестным стимулированием назначения и применения лекарств.
Ряд организаций, объединяющих производителей фармацевтических препаратов, для соблюдения своими членами требований российского законодательства, внесли в свои внутренние кодексы все те ограничения, которые наложило государство на продвижение рецептурных препаратов и взаимодействие с врачами и фармацевтами. В качестве примера приведу Кодекс надлежащей практики AIPM (Ассоциация международных фармацевтических производителей) в редакции 30.11.2015 года 11. В состав Ассоциации на сегодняшний день входит более 60-и производителей.
Сразу в водной части Кодекса объясняется, что это за документы и какова его важность для фармацевтической отрасли: « Примером локального нормотворчества, направленного на формирование оптимальной с точки зрения согласованности частных и публичных интересов модели поведения участников международного фармацевтического рынка является Кодекс надлежащей практики Ассоциации международных фармацевтических производителей (AIPM).Такого рода документ необходим в период форсированной модернизации законодательства, регулирующего медицинскую и фармацевтическую деятельность, когда в полную силу заработал Федеральный закон от 21 ноября 2011 г. №323-ФЗ «Об охране здоровья граждан в Российской Федерации», принят Федеральный закон от 20 июля 2012 г. №125-ФЗ «О донорстве крови и её компонентов», продолжается работа над совершенствованием Федерального закона от 12 апреля 2010 г. №61-ФЗ «Об обращении лекарственных средств», идет постоянное наполнение подзаконного уровня регулирования. При этом особенно важно сохранять надлежащий уровень регламентации отношений в сфере охраны здоровья граждан, а Кодекс, предложенный AIPM, безусловно, способен сыграть стабилизирующую роль в регулировании деятельности фармацевтических производителей в России. Положения Кодекса свидетельствуют о приверженности членов Ассоциации принципам социально ответственного бизнеса и добропорядочного поведения на фармацевтическом рынке, ориентированности на безусловное соблюдение норм российского законодательства. « 11
Распространяется действие Кодекса на большинство аспектов продвижения производителями продукции на фармацевтическом рынке страны:
– рекламу фармацевтических продуктов, адресованную населению;
– рекламу фармацевтических продуктов, адресованную специалистам здравоохранения;
– деятельность представителей фармацевтических компаний;
– взаимодействие со специалистами здравоохранения;
– взаимодействие с пациентскими организациями;
– пострегистрационные клинические (интервенционные), наблюдательные (неинтервенционные) и эпидемиологические исследования;
– маркетинговые исследования;
– распространение фармацевтическими компаниями или организациями, представляющими их интересы, информации, имеющей отношение к здоровью или заболеваниям человека;
– осуществление пожертвований и предоставление грантов;
– поддержку непрерывного медицинского образования;
– работу с запросами от пациентов и специалистов здравоохранения;
– мероприятия по продвижению фармацевтических продуктов для специалистов здравоохранения;
– спонсирование научных мероприятий, в которых принимают участие специалисты здравоохранения;
– использование сети Интернет и других цифровых каналов связи для продвижения фармацевтических продуктов;
– иные методы продвижения фармацевтических продуктов.
Настоящий Кодекс не распространяется на:
– маркировку фармацевтических продуктов, инструкции по применению и иную информацию, размещаемую на товаре или его упаковке;
– фактические и информационные заявления и ссылки, например, в отношении изменения упаковки, предупреждений о нежелательных реакциях как части общих мер по мониторингу безопасности;
– случаи установления цен и иных коммерческих условий поставки фармацевтических продуктов, включая торговые каталоги и прайс-листы при условии, что в них не содержатся конкретные утверждения рекламного характера о фармацевтическом продукте;
– предрегистрационные и регистрационные клинические исследования;
Читать дальшеИнтервал:
Закладка:










