Сэмюел Стернберг - Трещина в мироздании [litres]
- Название:Трещина в мироздании [litres]
- Автор:
- Жанр:
- Издательство:Литагент Corpus
- Год:2019
- Город:Москва
- ISBN:978-5-17-109309-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Сэмюел Стернберг - Трещина в мироздании [litres] краткое содержание
Трещина в мироздании [litres] - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
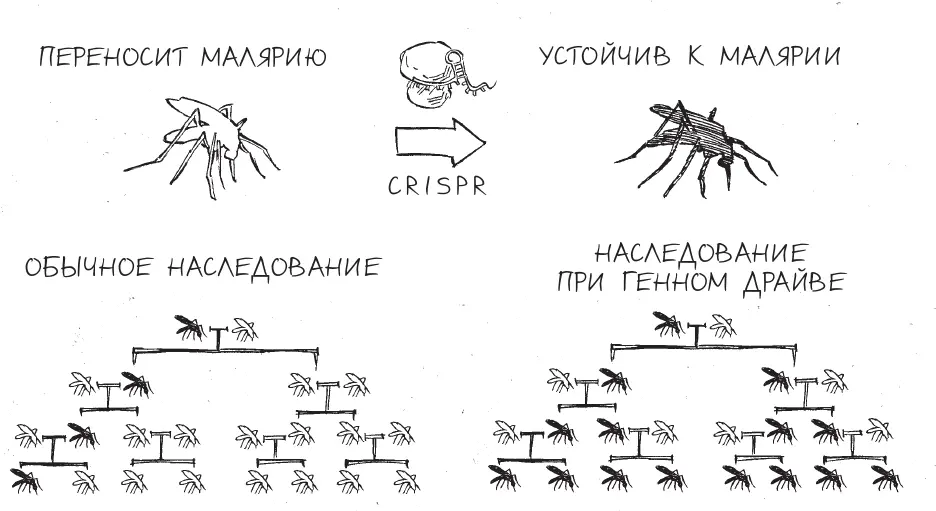
И тут на сцену выходит CRISPR. Летом 2014-го сотрудники лаборатории Джорджа Чёрча в Гарварде под руководством Кевина Эсвельта предложили метод конструирования и запуска генных драйвов с помощью высокоэффективного редактирования генома [180] K. M. Esvelt et al., “Concerning RNA-Guided Gene Drives for the Alteration of Wild Populations”, eLife 3 (2014): e03401.
. Вкратце, идея метода основана на подходе генного нокина ( gene knock-in ), при котором ученые используют CRISPR для разрезания ДНК в четко заданном месте и заделывают образовавшуюся брешь вставкой новой последовательности. Впрочем, есть одно существенное отличие от генного драйва: часть новой добавленной ДНК содержит генетическую информацию, кодирующую сам CRISPR. Словно в популярном научно-фантастическом сюжете о машине, которая сама себя собирает, генный драйв CRISPR может самостоятельно копироваться в новые хромосомы, обеспечивая для себя экспоненциальный рост численности в популяции. Эсвельт предположил, что, добавляя к CRISPR различные генетические грузы, такие как гены резистентности к болезнетворным организмам, ученые могут запрограммировать CRISPR на то, чтобы копировать не только самого себя, но и любые нужные последовательности ДНК.
Судя по всему, генные драйвы действительно могут быть настолько эффективными, как это предполагает теория. В начале 2015-го Итан Бир ( Ethan Bier ) и его аспирант Валентино Ганц в Калифорнийском университете в Сан-Диего сообщили о первой успешной демонстрации генного драйва с участием CRISPR у обыкновенной дрозофилы [181] V. M. Gantz and E. Bier, “The Mutagenic Chain Reaction: A Method for Converting Heterozygous to Homozygous Mutations”, Science 348 (2015): 442–444.
. Этот генный драйв использовали для введения дефектного гена окраски в геном насекомого. Вот что получилось: 97 процентов “отредактированных” мух были нового, желтого цвета вместо обычного желто-коричневого. Не прошло и полугода, как тот же коллектив получил вдобавок к этим результатам экспериментальной проверки концепции на плодовых мушках обнадеживающие данные тестов на комарах. Однако вместо того чтобы просто поменять цвет этих насекомых, новый генный драйв распространил в них ген, дающий устойчивость к малярийному плазмодию Plasmodium falciparum – паразиту, на счету которого сотни миллионов случаев малярии в год [182] V. M. Gantz et al., “Highly Efficient Cas9-Mediated Gene Drive for Population Modification of the Malaria Vector Mosquito Anopheles stephensi”, Proceedings of the National Academy of Sciences of the United States of America 112 (2015): E6736–43.
. Эффективность успешной передачи этого гена комарам оказалась еще выше, чем в случае с мушками: 99,5 %.
Первый из этих генных драйвов (изменение окраски) кажется безобидным, а второй (устойчивость к малярии) выглядит полезным [183] Поскольку “отредактированный” комар перестает быть носителем малярийных плазмодиев ( примеч. науч. ред. ).
. Но вот и третий пример. Работая независимо от калифорнийских ученых, британская команда исследователей – в ее состав входит и биолог Остин Берт, разработавший саму концепцию генного драйва, – создала легко передающиеся генные драйвы, распространяющие гены стерильности самок малярийных комаров [184] A. Hammond et al., “A CRISPR-Cas9 Gene Drive System Targeting Female Reproduction in the Malaria Mosquito Vector Anopheles gambiae ”, Nature Biotechnology 34 (2016): 78–83.
. Поскольку эта стерильность – рецессивный признак, гены должны были стремительно распространиться в популяции, а их частота должна была повышаться до тех пор, пока у каждой самки не окажется по две соответствующие копии, – и в этот момент наступит коллапс популяции. Вместо того чтобы избавиться от малярии, генетически изменив комаров таким образом, что они больше не были способны переносить заболевание, на этот раз был использован более грубый инструмент – истребление популяции, лишенной способности к размножению. Если бы этот подход был применен к популяциям комаров в природе, это могло бы в конце концов привести к полному уничтожению данного вида.
Это не первый случай, когда ученые обращаются к генной инженерии для снижения численности насекомых. Обычная практика, использующаяся уже несколько десятилетий, – выпуск в природу стерилизованных самцов; с помощью этой технологии фактически был уничтожен ряд вредителей сельского хозяйства в Северной и Центральной Америке [185] L. Alphey et al., “Sterile-Insect Methods for Control of Mosquito-Borne Diseases: An Analysis”, Vector Borne and Zoonotic Diseases 10 (2010): 295–311.
. Другой подход, который разрабатывает британская компания Oxitec , – вставка летального гена в геном комара; полевые испытания этого метода уже прошли в Малайзии, Бразилии и Панаме [186] L. Alvarez, “A Mosquito Solution (More Mosquitoes) Raises Heat in Florida Keys”, New York Times , February 19, 2015.
. Впрочем, в эти подходы изначально встроены самоограничения; генетические изменения быстро уничтожаются естественным отбором, и единственный способ действительно уменьшить численность комаров – периодически выпускать в природу большие партии модифицированных насекомых.
Использование CRISPR для создания генного драйва у комаров
В отличие от описанных выше, генные драйвы с CRISPR способны к самоподдержанию; поскольку характер наследования, по всей видимости, оказывается сильнее естественного отбора, модифицированные насекомые распространяются и передают свои дефектные признаки без ограничений. Эта устойчивость и делает генные драйвы такими мощными – и потенциально опасными – инструментами. Подсчеты показывают, что, если бы одна дрозофила из лаборатории в Сан-Диего в ходе первых экспериментов с генным драйвом оказалась на воле, она “раздала” бы кодирующие CRISPR гены (вместе с желтым цветом тела) 20–50 % всех плодовых мушек в мире [187] “Gene Intelligence”, Nature 531 (2016): 140.
.
Ученые, занимающиеся генными драйвами с использованием CRISPR, должны тщательно взвешивать риски перед каждым новым экспериментом; им необходимо разработать методические указания, обеспечивающие безопасность будущих исследований [188] O. S. Akbari et al., “Biosafety: Safeguarding Gene Drive Experiments in the Laboratory”, Science 349 (2015): 927–929.
. Возможно, наиболее очевидная гарантия того, что генный драйв случайно не вырвется в природу, – это жесткое ограничение: физические барьеры, отделяющие организмы от окружающей среды, и экологические барьеры между естественным ареалом конкретного организма и географическим положением лаборатории. На недавней конференции, где Итан Бир представлял результаты своих исследований, он показывал слушателям фотографии систем и процедур безопасности, призванных предотвратить случайный “побег” подопытных насекомых. Но ученые также предложили набор процедур для инактивации вышедших из-под контроля генных драйвов и на случай, если все принятые меры предосторожности окажутся неэффективными. Одна из таких процедур называется обратный драйв ( reversal drive ) [189] J. E. DiCarlo et al., “Safeguarding CRISPR/Cas9 Gene Drives in Yeast”, Nature Biotechnology 33 (2015): 1250–1255.
и представляет собой, по сути дела, антидот, перезаписывающий информацию поверх изменений в геноме, сделанных первым драйвом.
Интервал:
Закладка:
![Обложка книги Сэмюел Стернберг - Трещина в мироздании [litres]](/books/1076035/semyuel-sternberg-trechina-v-mirozdanii-litres.webp)




![Григорий Кузнецов - Руны. Ключи к энергии мироздания [litres]](/books/1057031/grigorij-kuznecov-runy-klyuchi-k-energii-mirozdaniya.webp)
![Сэмюел Сайкс - Семь клинков во мраке [litres]](/books/1057593/semyuel-sajks-sem-klinkov-vo-mrake-litres.webp)
![Сэмюел Сайкс - Десять железных стрел [litres]](/books/1143629/semyuel-sajks-desyat-zheleznyh-strel-litres.webp)
