Вильгельм Штрубе - Пути развития химии. Том 1. От первобытных времен до промышленной революции
- Название:Пути развития химии. Том 1. От первобытных времен до промышленной революции
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1984
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Вильгельм Штрубе - Пути развития химии. Том 1. От первобытных времен до промышленной революции краткое содержание
Пути развития химии. Том 1. От первобытных времен до промышленной революции - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Названия элементов подбирались таким образом, чтобы они отражали и особенности реагирования данного вещества. Так, элемент, который Пристли считал "дефлогистированным воздухом", Шееле — "огненным воздухом", а Лавуазье — "жизненным воздухом", стал называться по новой номенклатуре кислородом (oxygene) , так как этот газ при сгорании превращал многие вещества в "кислоты" [84] Кислотами в то время называли ангидриды кислот.- Прим. перев.
. "Горючий воздух" получил название водорода (hydrogene) , поскольку при его горении в кислороде образовывалась вода. "Удушливый воздух", согласно решению комиссии, стал называться азотом ("удушающее вещество"), потому что этот газ "душил" горение и дыхание [85] Происхождение названия "азот" рассматривается иначе в кн.: Трифонов Д. Н., Трифонов В. Д. Как были открыты химические элементы.- М.: Просвещение, 1980, с. 39-41.- Прим. перев.
.

Джозеф Пристли (1733-1804) (для проведения опытов с газами предложил новую конструкцию пневматической ванны с ртутным затвором и таким образом смог изолировать газы, растворимые в воде) [86] Пристли Джозеф (1733-1804) — английский ученый, основоположник (вместе с некоторыми другими химиками) химии газов ("пневматической химии", как ее называли в XVIII в.). Одним из первых получил кислород (1774 г.) и изучил его свойства, сумел выделить и исследовать такие важные для практики газообразные вещества, как хлороводород, оксиды азота, аммиак, сернистый газ. Подробно изучил свойства водорода и азота.- Прим. перев.
Кислоты получили названия от тех элементов, из которых они были образованы. Поэтому одна из кислот, в состав которой входила сера, стала называться теперь не "купоросным маслом", а серной кислотой. Кислоты, содержащие фосфор, комиссия постановила называть фосфорными кислотами; кислоту, в состав которой входит углерод,- угольной кислотой.
Новая терминология была прогрессивной, потому что в названиях соединений отражался их состав. Это значительно облегчило систематизацию веществ с учетом данных новейших экспериментальных исследований.
Генри Кавендиш (1731-1810) (один из самых знаменитых представителей пневматической химии, открыл многие газы и первый доказал образование воды при сгорании водорода) [87] Кавендиш Генри (1731-1810) — английский физик и химик, один из создателей химии газов. Впервые выделил в чистом виде водород и углекислый газ (1766 г.), определил плотность этих газов. Изучил реакции образования воды (1784 г.), получения серной кислоты (1785 г.), с высокой степенью точности установил состав воздуха (1781 г.).- Прим. перев.
Лавуазье совершил революционный переворот в химии. Но понять это смогли отнюдь не все химики XVIII в. Пристли, Шееле и Кавендиш, которые сами внесли столь важный вклад в подготовку этого "революционного переворота", так и остались приверженцами теории флогистона. Они пытались объяснить сделанные ими открытия в свете устаревших теорий. Только Лавуазье удалось рассмотреть эти явления с абсолютно иных позиций. Некоторые химики, как, например, Грен, пытались связать две системы воедино. Однако уже спустя примерно два десятилетия кислородная теория Лавуазье стала общепринятой. В начале XIX в. трудно было найти химиков, которые бы использовали в своих работах "язык" и понятия теории флогистона.
Широкое использование положений новой теории, новых понятий и обозначающих их терминов облегчили объяснение и понимание химиками результатов экспериментальных исследований Венцеля и Рихтера (проведенных еще во времена господства теории флогистона).
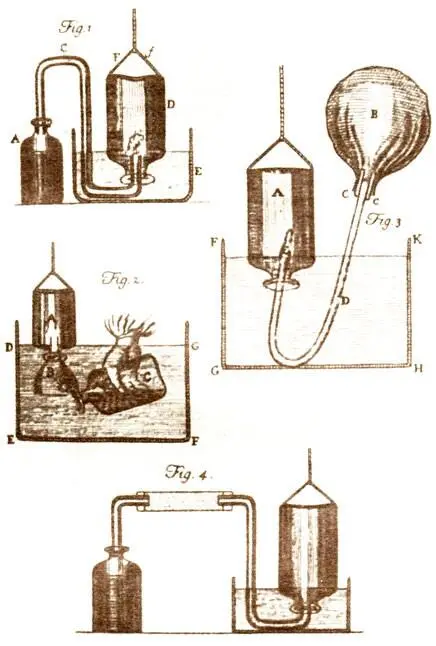
Аппараты Г. Кавендиша для выделения и улавливания газов
Примерно в это же время была решена и другая важнейшая проблема химии: показано, каким образом и в каких количественных отношениях соединяются элементы друг с другом. Пруст открыл закон постоянства состава веществ: химические элементы соединяются друг с другом в определенных (постоянных) весовых отношениях. Тогда же Джон Дальтон открыл закон кратных отношений: весовые соотношения двух элементов, которые образуют различные соединения (как, например, С и О составляют СО или С02), имеют вид простых целых чисел 1:1, 1:2, 1:3 и т. д. Широко используя на практике выводы из этого закона, Дальтон в начале XIX в. построил новую атомистическую теорию (химическую атомистику), а Якоб Берцелиус немного позже определил относительные атомные веса [атомные массы] и предложил обозначения элементов и их соединений, почти полностью сохранившиеся до наших дней. Таким образом, были созданы важнейшие положения классической химии.
В итоге в начале XIX в. изменилось и место химии среди других областей знания и производственной деятельности. Химия стала вполне самостоятельной научной дисциплиной, которая играла все возрастающую роль в промышленной революции XIX-XX вв.
Литература
1. Liebig J. v. Chemiesche Briefe. Leipzig und Heidelberg, 1865 (1. Aufl., 1844).
2. Полинг Л. Общая химия: Пер. с 3-го амер. изд. / Под ред. М. X. Карапетьянца.- М.: Мир, 1974.
3. Strube W. Die Chemie und ihre Geschichte. Berlin, 1974.
4. Walden P. Geschichte der Chemie. Bonn, 1950.
5. Karger-Decker B. Gifte, Hexensablen, Liebesgetranke. Leipzig, 1966.
6. Trommsdort J. B. Versuch einer allgemeinen Geschichte der Chemie, 1803-1805. In: Taschenbuch fur Arzte, Chemiker und Apotheker, 1806 gesondert als Buch. Nachgedruckt im Zentralantiquariat der DDR mit der im Druck von 1806 fehlenden Teilen und ainer Vorbemerkung von W. Strube. Leipzig, 1965.
7. Wiegleb J. Chr. Historisch-kritische Untersuchung der Alchemie, Weimar, 1777. Nachdruck des Zentralantiguariats der DDR, Leipzig, 1965.
8. Mottek H. Zu einigen Fragen der Entwicklung der Produktivkrafte und ihrer gesellschaftlichen Bedingungen. In: Jahrbuch fur Wirtschaftsgeschichte, 1964, T. II und III, S. 209 ff.
9. Kerstein G. Entschleierung der Materie. Stuttgart, 1962.
10. Meyer E. v. Geschichte der Chemie von den altesten Zeiten bis zur Gegenwart, 4. Aufl. Leipzig, 1914.
11. Kopp H. Geschichte der Chemie, Bd. I-IV. Braunschweig, 1843-1847.
12. Szabadvary F., Geschichte der analytischen Chemie, Budapest, 1960. Deutsche Bearbeitung v. G. Kerstein, Braunschweig — Budapest, 1966.
13. Fester G. Die Entwicklung der chemischen Technik bis zu den Anfangen der Grofiindustrie. Berlin, 1923.
14. Strube I. Bilder chemischer Vergangenheit. Leipzig, 1960.
15. Strube W. Erfahrungen und Theorien iiber chemische Vorgange in der Zeit von Thales beis Platon. In: Hellenische Poleis, Bd. IV.
16. Aristoteles. T. meth. t. phys. (- Prot. philos.) 1, 3, 983 b 6 ff.- 11 A 12 Diels Kranz.
17. Juncker J. Conspectus Chemiae theoretico practicae. Bd. I, II. Halle, 1730, 1738. Deutsch.: Vollstandige Abhandlung der Chemie. Bd. I-III, Halle, 1749 / 1753.
18. Strube W. Die Bedeutung des antiken Atomismus fur die Entwicklung der Experimentalchemie. In: Antiquitas Graeco-Romana ac tempora nostra, Acta congressus iniernaiionaiis hebiti Brunae..., Prag, 1968.
19. Платон, Соч., т. 1-3.- М.: Мысль, 1968-1972.
20. Strube I. Aristoteles und die Krise in den Lehren iiber chemischen Vorgange. In: Hellenische Poleis, hrg. v. E. Ch. Welskopf. Berlin, 1973, Bd. IV, S. 1839-1849.
Читать дальшеИнтервал:
Закладка:










