Михаил Супотницкий - Микроорганизмы, токсины и эпидемии
- Название:Микроорганизмы, токсины и эпидемии
- Автор:
- Жанр:
- Издательство:Вузовская книга
- Год:2006
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Супотницкий - Микроорганизмы, токсины и эпидемии краткое содержание
Кроме того, в монографии, впервые для отечественной литературы, обстоятельно освещены эпидемиология биологического террористического акта и методология выявления такого преступления. Книга хорошо иллюстрирована, содержит приложения и рассчитана на широкий круг специалистов.
Микроорганизмы, токсины и эпидемии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Роль комплекса HLAв устойчивости к малярии. Поскольку существуют значительные различия между экспонируемыми и неэкспонируемыми малярией людьми в частотах HLA-генов по локусам А и В, HLA-комплекс может защищать население на эндемичных по этой болезни территориях от паразитов, вызывающих малярию. Адекватные механизмы могут экспрессироваться HLA-ассоциированными генами, которые контролируют иммунологическую реактивность к антигенам малярии. Хорошо установлена связь между HLA-антигеном класса I, HLA-B53, и защитой от тяжелой формы малярии [Hill A. et al., 1992]. Эта связь может быть опосредованна ограниченными HLA класса I цитотоксическими Т-лимфоцитами на стадии пребывания паразита в печени. Среди иммунных к малярии африканцев НLА-В53-ограниченные CTL распознавали сохраненный неамерпептид из антигена, специфического для печеночной стадии, но ни один НLА-В53-ограниченный эпитоп не был идентифицирован в антигенах из других стадий развития паразита [Нill A. et al., 1992]. Эти данные демонстрируют возможную молекулярную основу для установления связи HLA с болезнью и поддерживают кандидатуру антигена, специфического для стадии печени, в качестве компонента вакцины против малярии [Singh N. et al., 1997].
Роль гена фактора некроза опухолей в клинических проявлениях малярии. Независимо от HLA-аллелей, аллель TNF2 гена фактора некроза опухолей альфа, показана как фактор, способствующий развитию церебральных форм малярии [McGuire W. et al., 1994]. От распространенного аллеля TNF1, TNF2 отличает более сильный транскрипционный активатор, способствующий увеличению экспрессии TNF-альфа. Видимо по этой причине у больных с церебральными формами малярии обычно находят повышенное содержание в крови TNF-альфа [Miller L., 1996]. Эта же аллель способствует более тяжелому течению инфекции, вызываемой хантавирусом Puumala (см. «Хантавирус Puumala»).
Роль гена внутриклеточного фактора адгезии 1 в клинических проявлениях малярии. Отдельные аллели гена ISAM-1 способствуют повышенной адгезии паразита к клеткам красной крови в эндотелии небольших сосудов, это сопровождается повышением чувствительности людей к церебральным формам малярии [Fernandez-Reyes D. et al., 1997].
Шистосоматоз.В исследованиях, проведенных с помощью сегрегационного анализа, показано, что среди населения Бразилии ген SM1 несет ответственность за 66 % случаев тяжелого течения болезни (рис. 54). Приблизительно 3 % бразильцев гомозиготны по этому гену и предрасположены к тяжелым формам течения болезни (АА-лица), 68 % гомозиготны по резистентности шистосоматозу (аа-лица), 29 % гетерозиготны и имеют промежуточный уровень резистентности к паразиту (Аа-лица).
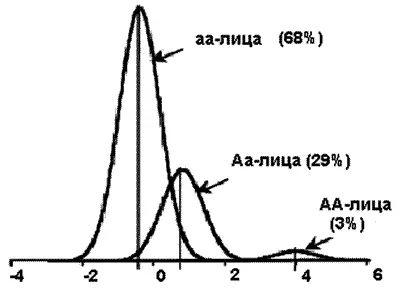
Рис. 54. Распределение гена, определяющего чувствительность популяции к возбудителю инфекционной болезни. На схеме показана частота аллеля А гена SM1, предрасполагающего к развитию шистосоматоза, среди населения Бразилии [Abel L., Desseint A., 1998].
Ген SM1 картирован в регионе хромосомы 5q31-q33, ответственном за контроль дифференциации Т-лимфоцитов [Marquet S. et al., 1996]. В дальнейших исследованиях этот регион был связан и с локусом, отвечающим за синтез иммуноглобулина Е (IgE) и образование эозинофилов. В регуляции устойчивости человека к шистосоматозу ген SM1 участвует через регулирование лимфокинами популяций Th2. Резистентные гомозиготы усиливают Th0/2-ответ, в тоже время чувствительные гомозиготы проявляют в отношении паразита Th0/1-ответ [Abel L., Desseint A., 1998].
Восприимчивость к возбудителю инфекционной болезни человеческой популяции или этнической группы всегда носит полигенный характер и определяется частотами встречаемости генов, продукты экспрессии которых способны усилить инфекционный процесс. Частоты таких генов в популяциях варьируют. Поэтому в любой популяции наблюдается множество переходных вариантов патологии между типичными формами проявления инфекционной болезни.
Генетическая устойчивость к развитию микробной инфекции может включать устойчивость к возникновению инфекции, т. е. устойчивость в первоначальной стадии размножения микроорганизма в хозяине и устойчивость к дальнейшему развитию болезни, т. е. Удержание инфекции в состоянии латентности. Генетическая устойчивость к паразитарным болезням носит более сложный характер, чем к бактериальным и вирусным, и предполагает наличие фазовой устойчивости, относящейся к определенным стадиям развития паразита.
Генетическая устойчивость (предрасположенность) к отдельным возбудителям инфекционных болезней может реализовываться непосредственно через иммунную систему и минуя её. Среди факторов иммунной системы, специфически связанных с развитием отдельных инфекций, наиболее изучена роль факторов, кодируемых генами МНС, ассоциации с инфекциями отдельных аллелей которых имеют универсальный характер. Показана роль в развитии инфекционных болезней мутаций генов регулирующих функцию фагоцитолиза (например, NRAMP1 для возбудителей ТВ и лепры); регулирующих активность иммунной системы (например, врожденная недостаточность системы интерферона при ТВ); контролирующих дифференциацию Т-лимфоцитов (например, дефектный ген SM1 при шистосоматозе) и др.
Среди генетических факторов, специфически влияющих на чувствительность к возбудителям инфекций, но не реализующихся через иммунную систему, можно выделить следующие: мутации в рецепторах, нарушающих механизм лиганд-рецепторного взаимодействия возбудителя с клеткой-мишенью (например, Duffy-мутация повышает устойчивость эритроцитов к малярийным плазмодиям, мутации гена рецептора CCR5 снижает риск инфицирования ВИЧ); мутации в субстратах, метаболизируемых узкоспециализированным паразитом (например, генетические дефекты гемоглобина определяют устойчивость к плазмодиям, вызывающим малярию); мутации в генах рецепторов, нарушающих взаимодействие клетки с витамином D и др.
Устойчивость к инфицированию возбудителями инфекционных болезней у рас, этнических групп, отдельных популяций, всегда носит относительный характер. После каждой крупной эпидемии из-за элиминации отдельных генотипов, чувствительность популяции меняется в отношении нескольких возбудителей инфекционных болезней одновременно.
Глава 2.4. Биологический террористический акт
Биологический террористический акт. Эпидемиология террористического акта при однократном применении биологического агента. Эпидемиология террористического акта при многократном применении биологического агента. Расследование биологического террористического акта. Вспышка сибирской язвы в Свердловске в 1979 году — бактериологическая диверсия?
Читать дальшеИнтервал:
Закладка:






![Михаил Супотницкий - Очерки истории чумы. Книга II. Чума бактериологического периода [без иллюстраций]](/books/1084186/mihail-supotnickij-ocherki-istorii-chumy-kniga-ii.webp)
![Михаил Супотницкий - Очерки истории чумы. Книга I. Чума добактериологического периода [без иллюстраций]](/books/1084187/mihail-supotnickij-ocherki-istorii-chumy-kniga-i-ch.webp)


