Михаил Супотницкий - Микроорганизмы, токсины и эпидемии
- Название:Микроорганизмы, токсины и эпидемии
- Автор:
- Жанр:
- Издательство:Вузовская книга
- Год:2006
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Супотницкий - Микроорганизмы, токсины и эпидемии краткое содержание
Кроме того, в монографии, впервые для отечественной литературы, обстоятельно освещены эпидемиология биологического террористического акта и методология выявления такого преступления. Книга хорошо иллюстрирована, содержит приложения и рассчитана на широкий круг специалистов.
Микроорганизмы, токсины и эпидемии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Адгезия бактериального патогена может осуществляться к компонентам внеклеточного матрикса — фибронектину, коллагену, ламинину и др. Матриксные белки имеют последовательность RGD, с которой взаимодействуют интегрины клеточной поверхности. Тем самым белки внеклеточного матрикса способствуют «приклеиванию» бактерий к клеткам-мишеням хозяина [Finlay В., Falkow S., 1997]. Адгезия бактерий к таким белкам носит специфический характер и каждый патоген реализует эту возможность «по-своему». Для проявления патогенности некоторых бактерий критическое значение имеет их взаимодействие с матриксными белками. Например, белок YadA способствует связыванию Yersinia enterocolitica с клеточным, но не плазменным фибронектином посредством адгезии с коллагенами и ламинининами. Утрата YadA снижает вирулентность возбудителя иерсиниоза для мышей почти в 100 раз [Pere J.C. et al., 1995].
В последние годы стало ясно, что адгезия бактерий не является простым механическим взаимодействием их лиганд-структур с рецепторами на поверхности клеток-мишеней хозяина, имеющими другое предназначение. Взаимодействие патогена с клеткой хозяина может приводить к активации сигнальных систем клеток непосредственно бактериальным компонентом, либо через стимуляцию активационных факторов хозяина, например, воспалительных цитокинов. Было показано, что энтеропатогенные кишечные палочки (ЕРЕС) секретируют белки, активирующие сигнальный путь, включающий фосфорилирование одного из белков клетки-хозяина — Нр90. После этого становится возможной адгезия бактерии к поверхности клетки. Самым удивительным для ученых, обнаружившим данное явление, оказалось то, что тирозин-фосфорилированная форма Нр90 и есть тот рецептор, с которым взаимодействует адгезии ЕРЕС — наружный мембранный белок интимин (94 кд), кодируемый еае-геном [Rosenshine et al., 1996; Goosney D. et al., 1999]. Механизм, запускающий инвазию бактерий после их адгезии к клеткам хозяина, включается еще до того, как эта адгезия произошла. Бактерии способны «чувствовать» свое окружение и регулировать плотность своих популяций посредством сигналов «от клетки к клетке» (рис. 7).
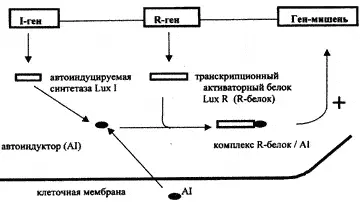
Рис. 7. Схематическое изображение запуска генов инвазии пролиферирующими бактериями. Самая простая система передачи сигнала «от клетки к клетке» предполагает взаимодействие двух генов. Первый — это ген I, кодирующий автоиндуцируемую синтетазу, второй — R-ген, кодирующий транскрипциональный активаторный белок (R-белок). Автоиндуцируемая синтетаза отвечает за синтез автоиндуцируемой молекулы (AI), которая проникает: через клеточную мембрану. С увеличением клеточной плотности внеклеточная концентрация AI возрастает тысячекратно, и AI связывает транскрипциональный активатор. Комплекс R-белок/АI активирует экспрессию гена-мишени, например, обеспечивающего бактерии способность проникать в клетку-мишень [Van Delden С, Iglewski В., 1998]
Заметим, что почти все факторы вирулентности бактерий строго регулируются, при этом их экспрессия связана с различными сигналами окружающей среды (температура, концентрация ионов, осмолярность, количество железа, рН, наличие источника углерода, содержание кислорода и др.). Патогены используют один или более из этих факторов для того, чтобы «понять» в какой микросреде, т. е., на какой стадии инфекционного процесса они находятся в настоящее время. Например, гены инвазии обычно включаются на ранней стадии инфекции, но подавляются, когда бактерии проникают внутрь клеток хозяина [Finlay В., Falkow S., 1997].
Обращает на себя внимание избыточность механизмов адгезии и колонизации у бактерий.
Инвазия.Многие патогенные микроорганизмы способны проникать в клетки хозяина и активно в них размножаться. Для проникновения в клетки бактерии используют адгезивные молекулы, называемые инвазинами. Наиболее распространенный механизм адгезии включает активацию сигналов в клетке хозяина, которые делают возможным инвазию бактерий посредством запуска нормальных клеточных реакций. Проникновение же бактерий в клетку обеспечивается элементами ее цитоскелета.
Некоторые патогены, например, Rickettsia prowazeckii, продуцируют фосфолипазы, разрушающие клеточную стенку вокруг «прилипшего» микроорганизма и он проникает непосредственно в цитоплазму [Walker D.H. et al., 1983]. Однако каким образом осуществляется контроль энзиматической деградации, предотвращающий клеточный лизис и как клетки хозяина восстанавливают свои мембраны после инвазии, остается неизвестным [Finlay В., Falkow S., 1997].
Рассмотрим более изученные механизмы инвазии. В табл. 1 сопоставлены механизмы инвазии некоторых патогенных бактерий.
Бактерия | Бактериальный инвазин | Рецептор(ы) хозяина | Особенности
Yersinia | Инвазин | бета 1-интегрин | «Зип-лайк» — фагоцитоз, инвазия опосредованная актином, но не разрушающая мембрану клетки, (активированная тирозинкиназой)
Yersinia | Yad A | бета1-интегрин | Менее эффективный чем инвазин
Yersinia | Ail |? | Инвазия неэффективна и менее специфична
L. monocytogenes | Интерналин | (Inl A) | Е-кадхерин | «Зип-лайк» — фагоцитоз, опосредованная актином, мембрана клетки не разрушается, активация тирозинкиназой
S. flexneri | Ipa-D | альфа5бета1-интегрин? | Разрушение мембраны, изменение клеточного цитоскелета без истечения кальция
S. typhimurium | SipB-D |? | «Рифление» мембраны, изменение клеточного цитоскелета, макропиноцитоз, ток кальция и некоторые другие сигналы (не ингибируемые киназными ингибиторами), формирование поверхностных отростков
Энтеропатогенная E. coli | Инвазин | Hp90 | Формирование «пьедестала» и тесная адгезия (зависимая от микротрубок и актина), опосредована тирозинкиназой
Pseudomonasaeruginosa . Возбудитель синегнойной инфекции продуцирует несколько внеклеточных белков, способствующих его инвазии и диссеминации (рис. 8).
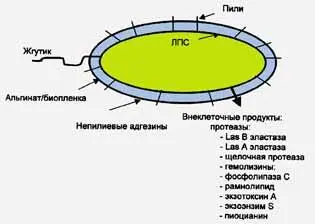
Рис. 8. Схематическое изображение факторов вирулентности Pseudomonas aeruginosa. P. aeruginosa имеет факторы вирулентности, связанные с клеткой (жгутики, пили, непилиевые адгезины, альгинат, ЛПС) и внеклеточные факторы вирулентности [Van Delden С., Iglewski В., 1998]
Прежде всего это экзотоксин А (является ADP-рибозилтрансферазой). Он способен инактивировать фактор элонгации 2 и тем самым ингибировать в клетке белковый синтез. Экзотоксин А ответственен за локальные повреждения тканей и иммуносупрессию. Экзоэнзим S также является ADP-рибозилтрансферазой, но преимущественно рибозилирут GTP-белки, такие как Ras. Он ответственен за непосредственное разрушение легочной ткани. Два гемолизина — фосфолипаза С и рамноллипид, могут действовать как синергисты при разрушении липидов и лектинов. Рамноллипид содержит детергент-подобную структуру и благодаря ей он растворяет фосфолипиды легочных тканей, делая их более доступными для разрушения фосфолипазой С. Протеазы (LasB-эластаза, LasA-эластаза и щелочная протеаза) играют основную роль во время острой фазы инфекции. Роль щелочной протеазы в инвазии P. aeruginosa, неизвестна. LasA-эластаза является сериновой протеазой и действует как синергист LasB-протеазы (цинк металлопротеаза) при деградации эластина легочной ткани. LasB-эластаза деградирует не только эластин, но и фибрин и коллаген, а также инактивирует человеческие иммуноглобулины G и А, компоненты комплемента и лизоцим, находящийся в воздушных путях, т. е., LasB-эластаза еще и препятствует действию механизмов защиты хозяина [Van Delden С, Iglewski В., 1998]. Система регуляции генов патогенности P. aeruginosa показана на рис. 9.
Читать дальшеИнтервал:
Закладка:






![Михаил Супотницкий - Очерки истории чумы. Книга II. Чума бактериологического периода [без иллюстраций]](/books/1084186/mihail-supotnickij-ocherki-istorii-chumy-kniga-ii.webp)
![Михаил Супотницкий - Очерки истории чумы. Книга I. Чума добактериологического периода [без иллюстраций]](/books/1084187/mihail-supotnickij-ocherki-istorii-chumy-kniga-i-ch.webp)


