Дмитрий Иванов - Нарушения обмена глюкозы у новорожденных детей
- Название:Нарушения обмена глюкозы у новорожденных детей
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Дмитрий Иванов - Нарушения обмена глюкозы у новорожденных детей краткое содержание
В работе представлен современный взгляд на нарушения обмена глюкозы у новорожденных детей. Описаны этиология, патогенез, клиника, основные методы лечения неонатальных гипо- и гипергликемий, неонатального сахарного диабета. Рассматривается влияние гипогликемии на нервно-психическое развитие.
Нарушения обмена глюкозы у новорожденных детей - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Больные с аутосомно-доминатной формой семейного гиперинсулинизма, в англоязычной литературе обозначаемой как FHI-GCK, вызванной мутациями в GCK , чаще всего манифестируют в возрасте одного года (диапазон от 2 дней до 30 лет). Как правило, данная форма, чаще всего протекает мягче, чем аутосомно-рецессивная, хотя некоторые больные нуждаются в агрессивной терапии.
Форма, сочетающая семейный гиперинсулинизм с гипераммониемией, чаще всего, протекает с умеренной гипераммониемией и поздним началом гипогликемии, как правило, не в периоде новорожденности [33, 140].
Таблица 9 Лабораторные тесты при семейном гиперинсулинизме (В. Glaser, 2010) [84]
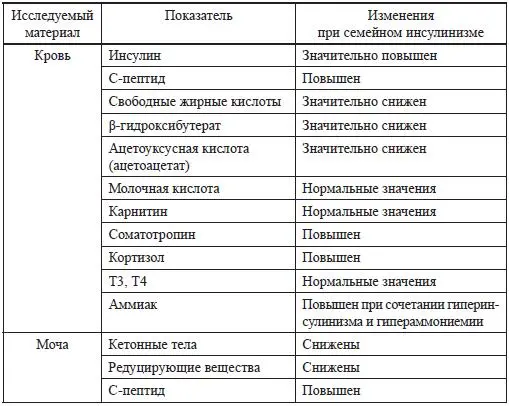
Имеются и еще более редко встречающиеся формы гиперинсулинизма у новорожденных детей. У 40 % больных с семейным гиперинсулинизмом вообще, по крайней мере на сегодня, не удается идентифицировать мутации ни в одном из генов, связанных с развитием этого заболевания.
При всех формах гиперинсулинизма необходима консультация хирурга (после генетического и лучевого исследования) по поводу возможного оперативного лечения (необходимость тотальной или субтотальной резекции поджелудочной железы) и обследование на врожденные наследственные дефекты метаболизма (см. ниже).
В лабораторной диагностике, позволяющей подтвердить диагноз семейного гиперинсулинизма, имеют значение следующие тесты (табл. 9).
При гистологическом исследовании поджелудочной железы при семейном гиперинсулинизме выделяют два основных гистологических типа:
Диффузный— увеличение количества β-клеток по всей поджелудочной железе. Встречается примерно у 60–70 % больных. При этом сохранена архитектура поджелудочной железы. В-клетки имеют большие ядра, выраженную цитоплазму и гистологические признаки повышенной метаболической активности.
Фокусная аденоматозная гиперплазия поджелудочной железы.Встречается примерно у 30–40 % больных с семейным гиперинсулинизмом. Отмечаются очаговые изменения в тканях поджелудочной железы, а остальные ткани железы являются функционально и гистологически нормальными. В отличие от опухолей (истинных аденом) макроскопически фокальные изменения не видны. В-клетки, вне очагов поражения, имеют маленькое ядро и цитоплазму, достаточно редко в них имеются гистологические признаки, свидетельствующие о том, что они функционально подавлены и не могут вырабатывать инсулин. Сканирование с помощью позитронно-эмиссионной томографии успешно используется для предоперационной локализации очаговых поражений [165, 152].
В настоящее время возможна пренатальная и предимплантационная генетическая диагностика для выявления заболевания у эмбриона или плода, но для этого необходима предварительная идентификация мутаций у родителей.
Дифференциальную диагностикусемейного гиперинсулинизма необходимо проводить с рядом заболеваний, сопровождающихся гипогликемией.
Около 30 % детей с синдромом Беквита-Видеманаимеют гиперин-сулинизм, приводящий к развитию гипогликемии, но она обычно течет менее злокачественно, по-сравнению с синдромом семейного инсулинизма, и поддается медикаментозной терапии.
Врожденные дефициты кортизола или гормона ростамогут иметь в клинической картине эпизоды гипогликемии, но она также обычно хорошо реагирует на заместительную гормональную терапию. Гипогликемия у новорожденных может проявляться как один признаков адреногенитального синдрома (дефицит 21-гидроксилазы). При этом необходимо помнить, что гипогликемия может быть одним из ранних симптомов при неклассических формах адреногенитального синдрома (дефицит 21-гидроксилазы с поздним началом).
Инсулиномы.Эти опухоли чрезвычайно редко встречаются у детей до года. Некоторые авторы [178] рассматривают семейные инсулиномы, как сложные эндокринные неоплазии 1-го типа, но они также редко встречаются у младенцев. Инсулиномы резко отличаются гистологически от низидиобластоза. Они являются истинными аденомами и состоят только из β-клеток.
Наследственные дефекты, связанные с нарушением продукции глюкозы.Эти заболевания, связанные с мутациями в генах, кодирующих ферменты, ответственные за продукцию или распад гликогена, в том числе гликогенсинтетазы (гликогеноз 0-го типа) или глюкоза-6-фосфатазы (гликогеноз 1-го типа). Оба эти заболевания проявляются гипогликемией, развивающейся натощак. У новорожденных детей клинические признаки развиваются в связи с поздним прикладыванием ребенка к груди или большими перерывами между кормлениями. Хотя клиническая картина очень вариабельна и во многом зависит от характера конкретной мутации.
Аналогично, мутации генов, кодирующих ферменты, участвующие в глюконеогенезе, также могут проявляться в клинической картине гипогликемией. Например, дефицит фруктоза— 1,6-дифосфатазы проявляется ацидозом и гипогликемией. Гипогликемия при указанном заболевании обычно менее выраженная, чем при гликогенозах и проявляется при голодании или интеркуррентных заболеваниях.
Дефекты метаболизма жирных кислот.В-окисление жирных кислот является важным источником энергии, особенно при голодании или острых патологических состояниях, например асфиксии новорожденных. Нарушения окисления жирных кислот, встречаются достаточно редко, но проявляются гипогликемией в неонатальный период [111, 135]. В процесс Р-окисления жирных кислот в митохондриях вовлекается целый каскад ферментов и коферментов (рис. 10). Нарушение этого процесса на любом уровне приводит к нарушениям усвоения жирных кислот, а, соответственно, к изменениям синтеза кетоновых тел. При возросшей потребности в кислороде, голодании, экстремальных состояниях окисление жирных кислот является основным субстратом энергии в мышцах, в том числе сердечной и гладкомышечных. Напротив, как мы уже отмечали, энергетические потребности нейронов, удовлетворяются прежде всего глюкозой и только при необходимости окислением кетоновых тел.
У больных с нарушением окисления жирных кислот имеются как гипогликемия, так и гипокетонемия, Они являются, таким образом, наиболее склонными к развитию «энергетического голодания» нейронов, а, соответственно, повреждению ЦНС. Конкретный биохимический механизм, приводящий при нарушениях окисления жирных кислот к гипогликемии не до конца ясен, но предполагают совместное влияние двух факторов:
• увеличенное потребление глюкозы тканями, прежде всего, мышечными, из-за отсутствия жирных кислот и кетонных тел, как альтернативных источников энергии, быстро исчерпывает запасы гликогена печени и нарушает глюконеогенез;
Читать дальшеИнтервал:
Закладка:









