Эрик Кандель - Расстроенная психика. Что рассказывает о нас необычный мозг
- Название:Расстроенная психика. Что рассказывает о нас необычный мозг
- Автор:
- Жанр:
- Издательство:Литагент Corpus
- Год:2021
- Город:М.
- ISBN:978-5-17-119013-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Эрик Кандель - Расстроенная психика. Что рассказывает о нас необычный мозг краткое содержание
В формате PDF A4 сохранен издательский макет книги.
Расстроенная психика. Что рассказывает о нас необычный мозг - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Одной альтернативой была операция. Первые эффективные хирургические вмешательства в ход болезни Паркинсона произвели через 150 лет после того, как Паркинсон впервые описал ее. Это сделали нейрохирурги, отчаянно желавшие помочь пациентам, которые страдали от сильного неконтролируемого тремора и скованности движений. Пользуясь в основном методом проб и ошибок, они выявляли в базальных ядрах и таламусе участки нейронных сетей, ответственные за тремор, и облегчали симптомы пациентов разрушением этих участков.
В 1970–1980 – х в понимании анатомии и физиологии двигательной системы произошел серьезный прогресс. Главный вклад в него внес Мэлон Делонг, который в те годы работал в Университете Джонса Хопкинса, а сегодня представляет Университет Эмори. Он обнаружил, что особый участок базальных ядер – субталамическое ядро — тоже богат производящими дофамин нейронами и играет важную роль в контроле движения 96 .
Пока Делонг изучал субталамическое ядро, на улицах появился новый наркотик, который дилеры прозвали синтетическим героином. Этот наркотик был загрязнен МФТП (1-метил-4-фенил-1,2,3,6-тетрагидропиридином) – веществом, которое вызывает замедленность движений, тремор и мышечную ригидность, характерные для болезни Паркинсона. При вскрытии нескольких молодых людей, умерших после принятия наркотика, было установлено, что МФТП разрушает субталамическое ядро, а с ним и клетки мозга, производящие дофамин. У выживших ущерб от МФТП был необратим, но они положительно реагировали на терапию леводопой.
Затем ученые использовали МФТП для моделирования болезни Паркинсона у обезьян. Они ожидали увидеть, что разрушение производящих дофамин клеток приводит к снижению активности субталамического ядра, вызывая симптомы болезни Паркинсона. Однако, начав записывать электрические сигналы отдельных нейронов в субталамическом ядре обезьян, Делонг обнаружил нечто иное: нейроны демонстрировали аномальную активность. К его удивлению, симптомы болезни Паркинсона вызывало не снижение, а аномальное повышение активности этих нейронов.
Чтобы проверить, виновна ли эта аномальная активность в паркинсонических треморе и ригидности, Делонг разрушил субталамическое ядро в одном полушарии мозга обезьяны и положил тем самым конец аномальной активности нейронов. В 1990 году он опубликовал поразительные результаты: повреждение субталамического ядра в каком-либо полушарии мозга обезьяны с болезнью Паркинсона приводило к исчезновению тремора и мышечной ригидности в противоположной половине ее тела 97 .
Открытие Делонга подтолкнуло нейрохирурга Алима-Луи Бенаби из Университета Жозефа Фурье во французском Гренобле задуматься о применении глубокой стимуляции мозга для лечения болезни Паркинсона. Как мы видели, глубокая стимуляция мозга предполагает вживление электродов в мозг и аккумуляторного устройства в другую часть тела. Устройство посылает высокочастотные электрические импульсы в нейронную сеть – в данном случае в субталамическое ядро. Импульсы заметно инактивируют сеть – подобно тому, как это делало повреждение субталамического ядра обезьяны, – не позволяя аномальной активности мешать контролируемым движениям (рис. 7.3). Такое лечение регулируемо, а его результат обратим.
К 1990-м годам глубокая стимуляция мозга практически вытеснила все остальные хирургические вмешательства при болезни Паркинсона. Она подходит не каждому и не исцеляет больного, а лишь воздействует на симптомы. Если генератор электрических импульсов выходит из строя или разрывается контакт проводов – что, конечно, случается нечасто, – польза от лечения почти мгновенно пропадает.
Глубокую стимуляцию мозга успешно применяют и для лечения таких психических расстройств, как депрессия. Вместо стимуляции моторной сети, применяемой для устранения симптомов двигательных нарушений, в этом случае электрические импульсы стимулируют систему вознаграждения для устранения симптомов депрессии. Таким образом, глубокая стимуляция мозга может оказаться методом лечения даже не отдельных болезней, а отдельных нейронных сетей.
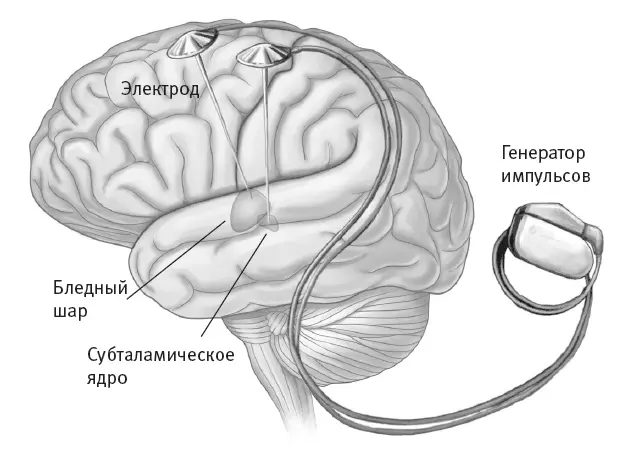
Рис. 7.3.Глубокая стимуляция мозга. Бледный шар – парная подкорковая структура, участвующая в регуляции произвольных движений; основной компонент базальных ядер.
Болезнь Хантингтона
Болезнью Хантингтона в США страдает около 30 тысяч человек, и это расстройство в равной степени поражает мужчин и женщин. Возраст проявления первых симптомов сильно варьирует, но в среднем составляет 40 лет. Впервые эту болезнь в 1872 году описал окончивший Колумбийский университет американский врач Джордж Хантингтон. Он указал на характерные для заболевания непроизвольные движения, изменения в характере и когнитивной сфере больных, а также на наследственную природу этой патологии. Описание было таким ясным и точным, что по нему другие врачи сразу смогли диагностировать болезнь и назвали ее в честь Хантингтона.
В отличие от болезни Паркинсона, которая на ранних стадиях достаточно локализована, болезнь Хантингтона может распространяться довольно быстро и приводить к когнитивным и моторным нарушениям, включая расстройства сна и деменцию. Первым делом она поражает базальные ядра, но распространяется и на кору, гиппокамп, гипоталамус, таламус, а иногда и на мозжечок (рис. 7.4).
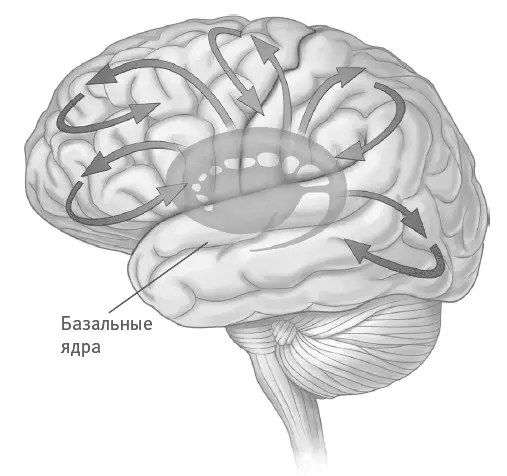
Рис. 7.4.Болезнь Хантингтона начинается с поражения базальных ядер, а затем распространяется по коре головного мозга.
Потребовалось много лет, чтобы продвинуться в изучении болезни Хантингтона, но в 1968 году знаменитый психоаналитик Милтон Уэкслер, у жены которого развилась эта болезнь, основал Фонд борьбы с наследственными заболеваниями. Он хотел достичь двух целей: привлечь средства для проведения базовых исследований и собрать ученых для исследования болезни Хантингтона. Этот фонд значительно повлиял на углубление наших представлений о болезни.
Поскольку болезнь Хантингтона передается по наследству, сначала фонд сосредоточился на поиске критичного для ее развития гена. В 1983 году Дэвид Хаусман и Джеймс Гузелла применили новую стратегию, называемую амплификацией экзонов [78] Речь идет об избирательной ПЦР-амплификации экзонов – тех участков гена, которые, в отличие от интронов , не вырежутся за ненадобностью при процессинге РНК, то есть именно их нуклеотидная последовательность в итоге “перепишется” в аминокислотную последовательность белка.
, и связали болезнь Хантингтона с геном на кончике 4-й хромосомы. Этот ген назвали huntingtin [79] Хантингтином , но именно латиницей – huntingtin, иногда называют не только белок, но и кодирующий его ген. Во втором случае при написании применяют курсив. Другие обозначения этого гена – HTT и HD .
98 .
Интервал:
Закладка: