Михаил Никитин - Происхождение жизни. От туманности до клетки
- Название:Происхождение жизни. От туманности до клетки
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2016
- Город:Москва
- ISBN:978-5-9614-4350-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Никитин - Происхождение жизни. От туманности до клетки краткое содержание
Происхождение жизни. От туманности до клетки - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Эту теорию в современном виде выдвинули вирусологи Филипп Джон Белл и Масахара Такемура (Bell, 2001; Takemura, 2001; Bell, 2009). Они утверждают, что ядро эукариотической клетки происходит от крупного ДНК-вируса, заразившего древнюю архею. Этот вирус мог перейти к умеренной эксплуатации хозяина: он не убивал его сразу (это явление называется лизисом), а сосуществовал, медленно размножая свою ДНК в его клетках (лизогения). Постепенно такой вирус мог взять клетку хозяина под полный контроль. Поначалу другие ученые практически не рассматривали эту теорию всерьез, но в последнее время она стала набирать популярность – так, к ее обсуждению подключился крупнейший французский вирусолог Патрик Фортерр.
Ключевую стадию пришивания кэпа проводит фермент гуанилил-трансфераза. Поскольку эукариотические рибосомы не связываются с мРНК без кэпа, вирусы эукариот для синтеза своих белков должны как-то решать эту проблему. Мелкие ДНК-вирусы, умеющие проникать в ядро сквозь ядерные поры, обычно используют гуанилил-трансферазу хозяина. РНК-вирусы создают на 5' концах своих мРНК сложные конструкции из шпилек (они называются IRES), которые имитируют форму белка eIF4E и позволяют РНК связаться с рибосомой без участия кэпа и eIF4E. Крупные ДНК-вирусы обычно имеют свою собственную гуанилилтрансферазу и производят матричные РНК с кэпами. В ходе эволюции эти ферменты могли передаваться между хозяевами и вирусами в обоих направлениях, но где они появились исходно?
Белл провел филогенетический анализ ферментов пришивания кэпа, который показывает, что ферменты эукариот образуют на дереве единую самостоятельную ветвь (рис. 18.12). Случай переноса фермента из клетки вирусу отразился бы на этом дереве вирусной веткой среди эукариот, но ничего такого мы не видим. А значит, следов переноса гуанилилтрансферазы от клеток вирусам нет.
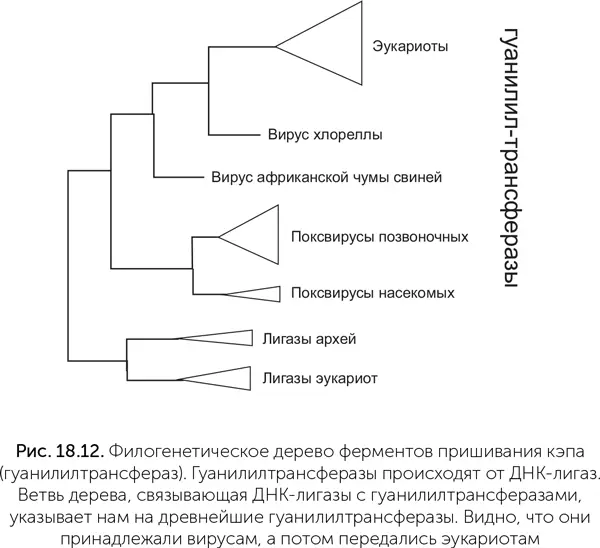
Чтобы понять, какой из узлов дерева гуанилилтрансфераз самый древний и соответствует предковому ферменту, к ним добавлены родственные ферменты – АТФ-зависимые ДНК-лигазы. Это более древние белки, предковые по отношению к гуанилилтрансферазам. Соответственно, та часть дерева гуанилилтрансфераз, которая выходит из лигазной части дерева, укажет нам древнейшую гуанилилтрансферазу. Оказывается, она принадлежала вирусам: первая ветвь ее потомков содержит ферменты поксвирусов (вирус оспы и его родственники), вторая – ферменты вируса ASF (африканской чумы свиней – African swine fever) и третья – вируса хлореллы. Гуанилилтрансферазы эукариот происходят от фермента вирусной линии, давшей начало вирусам ASF и хлореллы. Это доказывает, что кэпирование мРНК, как и другие инновации в генетических системах, появилось сначала среди вирусов и лишь затем было заимствовано эукариотами.
Для вирусов, в отличие от клеток, есть очевидная выгода в создании такой системы. Это средство перехвата управления клеткой хозяина. Вирус вносит в клетку фермент, который разрушает клеточные матричные РНК без кэпа и не трогает вирусные мРНК с кэпом. Белок eIF4E тоже мог сначала появиться у вирусов как средство захвата рибосом хозяина. Он присоединяется к рибосомам, после чего они узнают только вирусные мРНК с кэпом, останавливая синтез белков клетки. Современные клеточные eIF4E обычно связаны с рибосомами. У мимивируса [21]обнаружен собственный белок-аналог eIF4E, роль его пока непонятна.
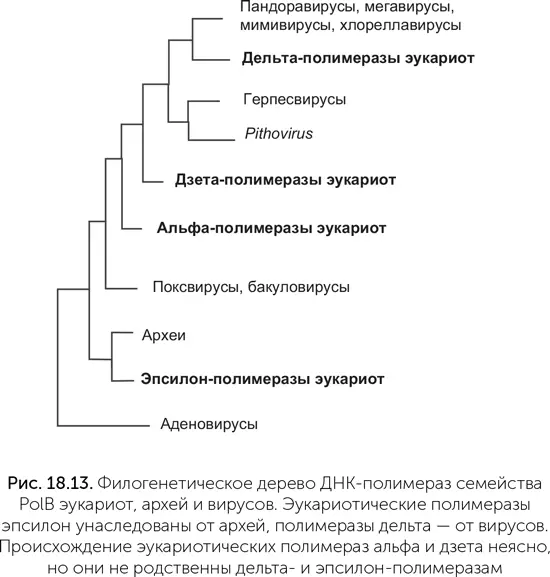
Такемура обратил внимание на систему репликации ДНК эукариот. По сравнению с машинами репликации бактерий и архей эукариотическая версия сложна и медлительна. Если у бактерий и архей скорость репликации составляет около 1000 нуклеотидов в секунду, то у эукариот обычно около 50. Там, где многие бактерии и археи обходятся одной ДНК-полимеразой (см. главу 14), эукариоты используют три родственные. Дельта-полимераза копирует отстающую цепь, эпсилон-полимераза – лидирующую, а альфа-полимераза имеет неожиданную функцию. Она удлиняет РНК-затравки на 15–20 нуклеотидов уже из ДНК, после чего уступает место полимеразам дельта и эпсилон. Альфа-полимераза часто делает ошибки, поэтому созданные ею фрагменты ДНК потом удаляются одновременно с РНК-затравками, и дельта-полимераза строит на их месте точные копии ДНК-матрицы. Кроме этих трех ДНК-полимераз у большинства эукариот есть четвертая – дзета-полимераза. Она заменяет другие полимеразы, когда нужно срочно скопировать поврежденную ДНК и нет времени на ее починку.
Все четыре эукариотические полимеразы принадлежат к семейству PolB (глава 14), но достаточно сильно различаются между собой. На родословном дереве ДНК-полимераз эукариот, архей и вирусов (рис. 18.13) хорошо видно, что полимераза эпсилон унаследована эукариотами от архей, полимераза дельта – от вирусов, а полимеразы альфа и дзета образуют отдельные ветви, начинающиеся ближе к корню дерева, чем δ. Об их происхождении нельзя судить точно, но они тоже могли попасть в клетки эукариот от каких-то вымерших или еще не открытых вирусов.
Наконец, Патрик Фортерр связал с вирусами происхождение огромного количества эукариотических белков, которые не похожи ни на какие белки бактерий и архей (Forterre, 2011). По последним оценкам, общий предок современных линий эукариот уже имел более 1400 таких белков. Среди них преобладают вспомогательные белки цитоскелета и ДНК-связывающие белки, в структуре которых присутствуют многочисленные короткие повторы. Вирусы, особенно крупные, содержат много генов, не похожих ни на какие гены клеточных организмов, а часто и на гены других вирусов. Кодируемые ими белки тоже часто имеют множественные короткие повторы. Низкая точность вирусных полимераз, интенсивная рекомбинация и «гонка вооружений» с хозяевами приводят к очень быстрой эволюции вирусных белков по сравнению с клеточными, поэтому вирусы – обильный источник принципиально новых белков.
Вирусная теория происхождения ядра и полового размножения
К крупным ДНК-вирусам (LNCDV, Large Nucleo-Cytoplasmic DNA Viruses) относятся, например, поксвирусы (из них широко известен возбудитель оспы), мимивирусы (недавно открытая группа гигантских вирусов-паразитов амеб) и фикоднавирусы, поражающие водоросли. Они имеют крупную и сложную вирусную частицу, покрытую несколькими мембранами. Самая внешняя мембрана сливается с наружной мембраной клетки при заражении, и в цитоплазму попадает вирус, окруженный двумя внутренними мембранами. Эти мембраны местами сливаются между собой, образуя некое подобие ядерных пор. Они выстланы изнутри белками капсида (вирусной оболочки), аналогичными белкам ядерной оболочки. В такой форме вирус долго существует в цитоплазме, в нем происходят транскрипция, кэпирование и полиаденилирование РНК, экспорт зрелых РНК в цитоплазму через поры вирусной частицы. Вирусы оспы раньше называли «мини-ядрами», а вирион мимивируса по размеру почти не уступает ядру клетки-хозяина.
Читать дальшеИнтервал:
Закладка:







