Михаил Никитин - Происхождение жизни. От туманности до клетки
- Название:Происхождение жизни. От туманности до клетки
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2016
- Город:Москва
- ISBN:978-5-9614-4350-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Никитин - Происхождение жизни. От туманности до клетки краткое содержание
Происхождение жизни. От туманности до клетки - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
В ходе денитрификации нитрат восстанавливается до азота в четыре стадии:
NO 3 -→ NO 2 -→ NO → N 2O → N 2.
Каждая из четырех реакций катализируется своим ферментом. Типичная дыхательная цепь денитрификации похожа на цепь, работающую в аэробном дыхании: в ее составе тоже есть комплекс I (НАДН-дегидрогеназа) и комплекс III (цитохромный комплекс bc 1 , в состав которого входят цитохромы b и с ), между которыми электроны переносятся при помощи хинонов. Однако если аэробная дыхательная цепь линейна, то дыхательная цепь денитрификации разветвляется в двух местах. Хиноны в ней переносят электроны не только к цитохрому bc 1 , но и к нитрат-редуктазе, а после цитохрома bc 1 подвижный малый цитохром с доставляет электроны по трем разным адресам: на нитрит-редуктазу, NO-редуктазу и N 2O-редуктазу (рис. 17.5).
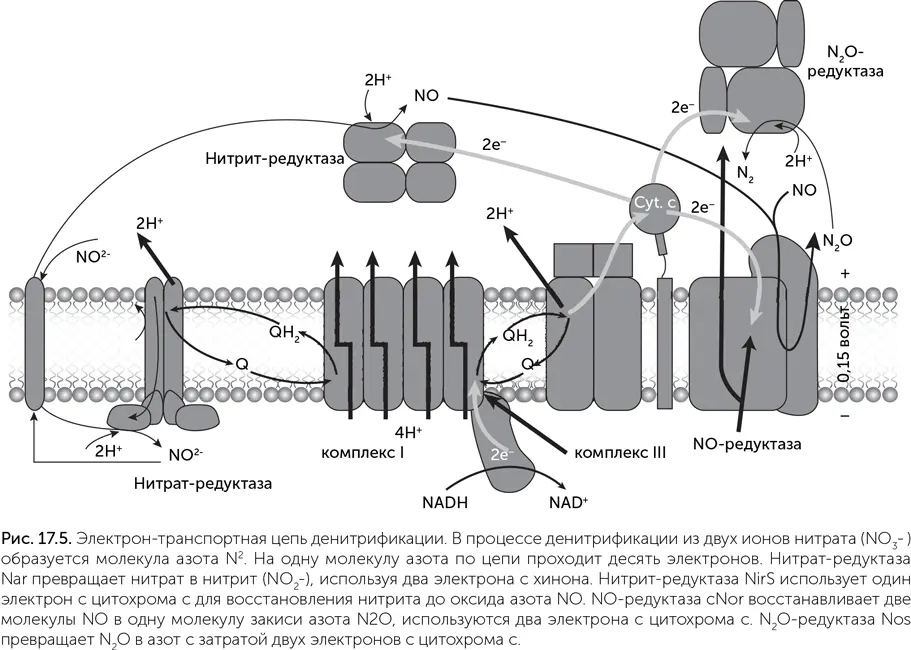
Из-за разветвления дыхательная цепь денитрификации нуждается в тонком управлении распределения тока. Например, нитрит-редуктаза производит ядовитый оксид азота NO. В норме его концентрация очень мала, потому что NO-редуктаза быстро превращает NO в безопасный N 2O. Но если NO-редуктазе не хватит электронов, клетка отравит сама себя оксидом азота. Поэтому дыхательная цепь денитрификации качает меньше протонов, чем могла бы, – меньшая эффективность оказывается платой за безопасность. Кроме изображенного на рисунке варианта существуют более простые денитрификационные дыхательные цепи, в которых нет комплекса III, а все четыре редуктазы получают электроны прямо с хинона. Они проще в управлении, но переносят меньше протонов через мембрану.
Все известные варианты дыхательных цепей денитрификации, аммонификации и других окислительно-восстановительных превращений соединений азота используют компоненты, возникшие в эволюции после LUCA: цитохромы c и медьсодержащие ферменты. Медь входит в состав активного центра N 2O-редуктазы и вспомогательных субъединиц NO-редуктазы. Так что их появление в эволюции, видимо, произошло уже после возникновения основных групп бактерий.
Восстановление сульфата, как и нитрата, происходит в несколько этапов. Поскольку сульфат – очень слабый окислитель, то он нуждается в активации с помощью АТФ. Сульфат превращается в аденозил-фосфосульфат, который далее восстанавливается до сульфита, серы и сероводорода:
SO 4 2-→ аденозил-фосфо-SO 4 -→ SO 3 2-→ S → H 2S.
Аденозил-фосфосульфат-редуктаза (Apr) получает электроны не от обычных переносчиков, а от белкового комплекса-партнера, который называется Qmo (рис. 17.6). Даже с учетом активации АТФ сульфат – слишком слабый окислитель, чтобы принимать электроны с хинона. Поэтому комплекс Qmo объединяет в один ток электроны из двух источников с разным напряжением: от хинона (слабый восстановитель) и от ферредоксина (сильный восстановитель). Благодаря этому Apr может восстановить сульфат до сульфита. Работа комплекса Qmo называется «электронная конфуркация».
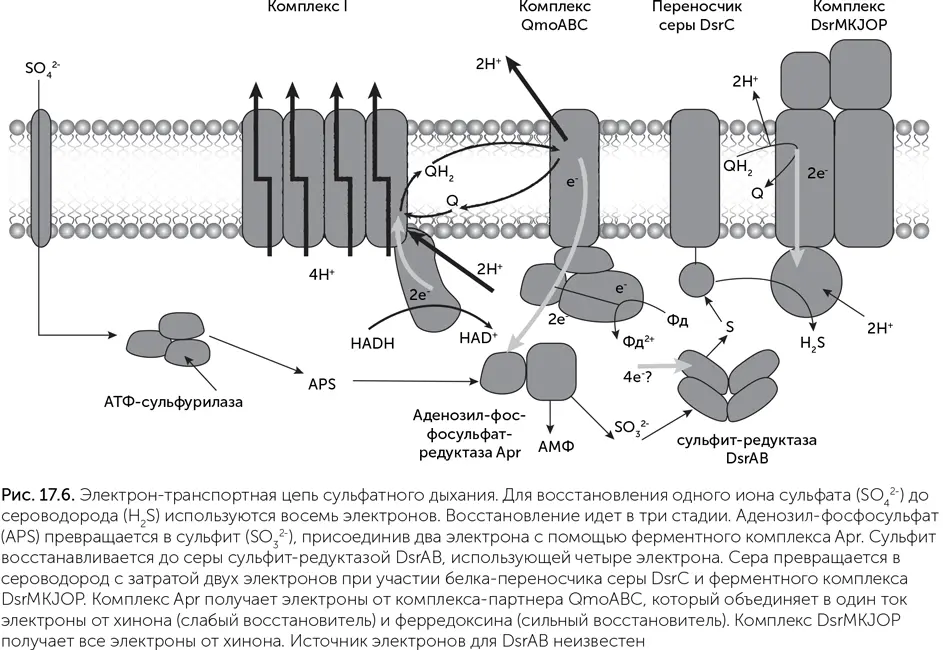
Дальше работает диссимиляторная сульфит-редуктаза (DsrAB), которая восстанавливает сульфит до серы, перенося четыре электрона. В клетках сера из активного центра сульфит-редуктазы выходит при помощи вспомогательного белка DsrC, молекула которого имеет длинную «ручку» с двумя остатками цистеина. Сера реагирует с этими цистеинами, превращаясь в H 2S, а цистеины окисляются в дисульфидный мостик. Другой ферментный комплекс, гетеродисульфид-редуктаза (DsrMKJOP), восстанавливает этот дисульфидный мостик обратно, получая электроны с хинона. У многих бактерий эта система работает в обратном направлении, окисляя сероводород и серу до сульфита, например, в процессах фотосинтеза и диспропорционирования серы.
Комплексы сульфатного дыхания устроены достаточно однотипны у разных организмов, кроме того, сульфатное дыхание – признак нескольких древних, рано ответвляющихся групп архей и бактерий. Оно обходится без меди и обычно без цитохромов c . Субъединицы одного из его ферментов, сульфит-редуктазы DsrAB, судя по филогенетическому дереву, появились при дупликации генов еще до LUCA. Все это говорит о большой древности этого пути метаболизма.
Модульная структура окислительно-восстановительных ферментов
Изучение большого разнообразия дыхательных цепей показывает, что множество ферментных комплексов, работающих с разными веществами, строятся из небольшого набора субъединиц, как в конструкторе LEGO (Baymann et al., 2003). В простейшем случае дыхательная цепь состоит из двух комплексов, перенос электронов между которыми осуществляется хиноном. Каждый из двух комплексов включает как минимум три блока:
• каталитическая субъединица получает электроны от восстановителя;
• мембранная субъединица отдает электроны на хинон;
• соединительная субъединица работает «проводом» между двумя другими.
Среди каталитических субъединиц выделяются своей универсальностью молибденовые оксидоредуктазы (их еще называют CISM – Complex Iron-Sulfur Molibden). Это семейство ферментов восстанавливает гидрокарбонат (до муравьиной кислоты), нитрат (до нитрита), хлорат, перхлорат, арсенат, селенат, полисульфиды, диметилсульфоксид, триметиламиноксид и даже хлорорганические вещества. В состав этой субъединицы входит молибден, связанный с двумя молекулами витамина В 9(этот комплекс называется «молибденовый кофактор», MoCo), и один 4Fe-4S кластер (рис. 17.7).
Гетеродисульфид-редуктазная субъединица содержит три железосерных кластера 4Fe-4S (один из них связан с белком через пять атомов серы, а не через четыре, как обычно). Она входит в состав нескольких ферментов метаногенеза и сульфатного дыхания, у метаногенов восстанавливает дисульфидный мостик между двумя коферментами (CoB-S-S-CoM), у сульфатредукторов – мостик между двумя цистеинами в переносящем серу белке DsrC.
NiFe-гидрогеназная субъединица работает с молекулярным водородом (Н 2). Она входит в состав разных гидрогеназ, мембранных и растворимых, поглощающих и выделяющих водород, а также формат-гидрогенлиазы и даже комплекса I (НАДН-хинон-оксидоредуктазы), и сочетается с разными «проводами» и хинонными портами.
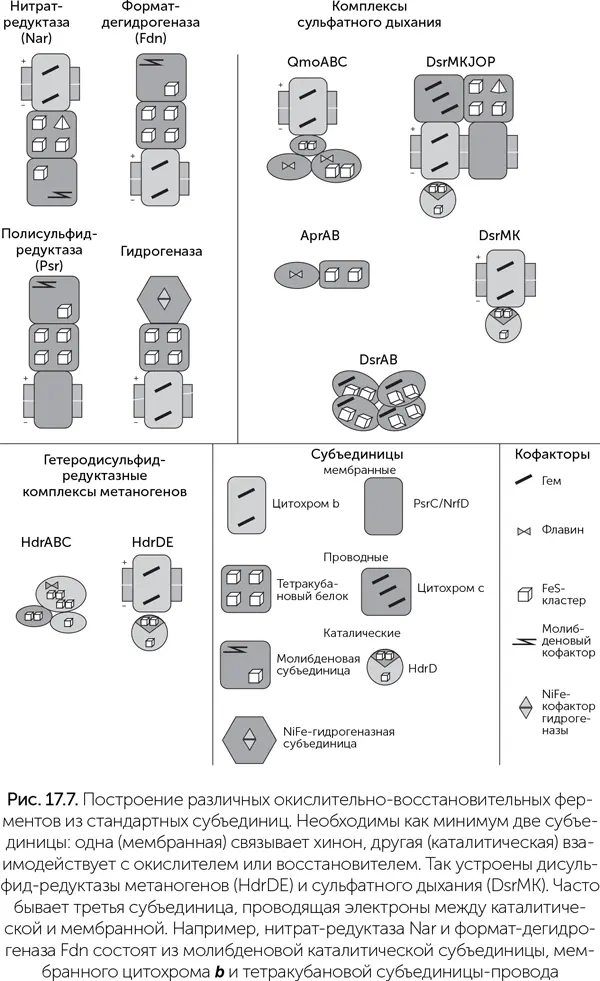
Трансмембранные цитохромы b сочетают функции «проводов» и «хинонных разъемов» и используются, когда каталитическая субъединица должна быть по одну сторону мембраны, а хинон – по другую. Они содержат два гема b и входят в состав формат-дегидрогеназы, нитрат-редуктазы, гидрогеназ, комплекса b 6f в фотосинтезе и многих других ферментов.
Читать дальшеИнтервал:
Закладка:







