Михаил Никитин - Происхождение жизни. От туманности до клетки
- Название:Происхождение жизни. От туманности до клетки
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2016
- Город:Москва
- ISBN:978-5-9614-4350-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Никитин - Происхождение жизни. От туманности до клетки краткое содержание
Происхождение жизни. От туманности до клетки - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Разнообразие и эволюция гем-содержащих белков
Цитохромы были открыты и разделены на типы ( а, b, c ) еще в конце XIX века по своим спектроскопическим свойствам – грубо говоря, по цвету. Первое время после открытия гемов считалось, что каждому типу цитохромов соответствует свой тип гема, отличающийся боковыми группами порфиринового кольца. Потом оказалось, что реально существуют только гемы a, b и d 1 . Цитохромы с содержат гем b , но отличаются от прочих типов цитохромов способом соединения гема с белком. В цитохромах с гем соединен с белковой молекулой двумя прочными ковалентными связями, а в цитохромах а, b и d – только слабыми координационными связями. Цитохромы a и b образуются самопроизвольно в пробирке из очищенного белка и гема. Ковалентное соединение гема с белком в цитохромах c образуется при помощи специальных ферментов. Так что в эволюции цитохромы с должны были возникнуть позже, чем другие типы цитохромов. Распространение цитохромов с и филогенетические деревья ферментов, соединяющих гем с белком, показывают, что цитохромы с появились уже после появления основных групп бактерий. Их изобретателями могли быть протеобактерии или цианобактерии, а возможно, и те и другие независимо. Дальнейшее распространение цитохромов с по другим группам бактерий и архей происходило путем горизонтального переноса генов. Благодаря прочным ковалентным связям гема с белковой цепью в цитохромах с они гораздо устойчивее и могут участвовать в большем разнообразии реакций, чем цитохромы a и b .
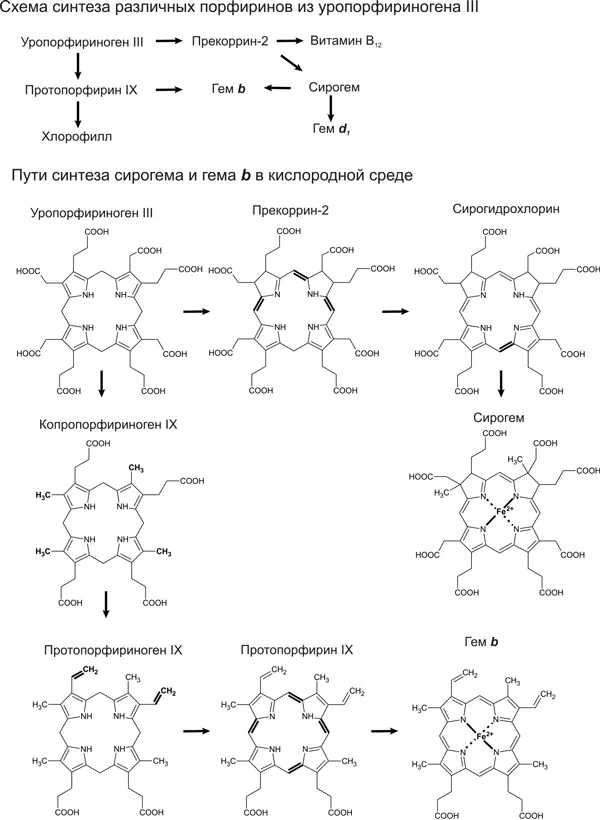
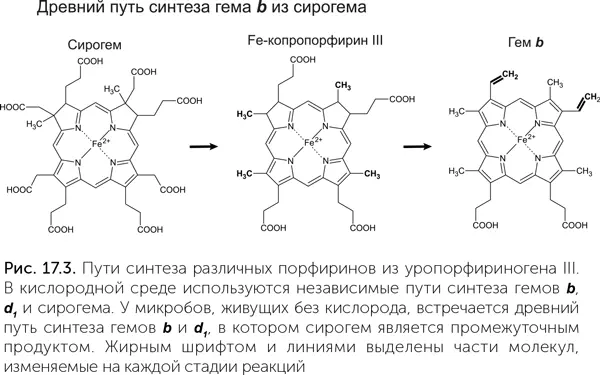
О сирогем-содержащих белках мы можем с уверенностью сказать, что у LUCA из них была диссимиляторная сульфит-редуктаза (Dsr). Она восстанавливает сульфит (SO 3 2-) до серы в сульфатном дыхании либо, наоборот, окисляет серу до сульфита в серном фотосинтезе. Молекула этого фермента состоит из двух похожих субъединиц, каждая из которых связывает сирогем, но только один из двух сирогемов образует активный центр. Значит, древний вариант сульфит-редуктазы Dsr состоял из двух одинаковых белковых половинок, кодируемых одним геном, и имел два активных центра. Филогенетическое дерево белковых субъединиц этого фермента однозначно показывает, что дупликация гена, давшая начало двум разным субъединицам, произошла до разделения бактерий и архей (Dhillon et al., 2005). Ассимиляторная сульфит-редуктаза (Asr) по структуре похожа на сульфит-редуктазу Dsr, но две субъединицы у нее слились в единую белковую цепь, а неработающий второй сирогем был утрачен. Подобной структурой обладает и нитрит-редуктаза. Усиление различий между субъединицами и их слияние указывают, что нитрит-редуктаза и сульфит-редуктаза Asr произошли от Dsr. Это согласуется и с их функциями: редуктаза Asr образует сероводород из сульфита, нитрит-редуктаза – аммиак из нитрита, а в геотермальных водоемах, где обитал LUCA, сероводород и аммиак были в достатке. Сульфит-редуктаза Dsr же может работать в обратном направлении, окисляя серу; и в этом качестве могла быть востребована у LUCA, например, в процессе фотосинтеза.
Итак, мы можем быть уверены, что из разнообразия порфиринов LUCA могли быть сирогем, участвующий в окислении серы, и витамин В 12, работающий, среди прочего, в восстановительном ацетил-КоА-пути фиксации углекислого раза (см. главу 11). О древности других порфиринов мы не можем судить так же достоверно. Гемы a и b участвуют во множестве окислительно-восстановительных реакций, и у нас нет четких аргументов ни за, ни против их присутствия у LUCA. Хлорофиллы или промежуточные продукты их синтеза (протохлорофиллиды) могли быть у LUCA в качестве защитных пигментов. Нельзя исключать, что эту же функцию защиты от ультрафиолета могли выполнять какие-нибудь другие порфирины, которые не сохранились до нашего времени.
Разнообразие и эволюция хинонов
В разных группах бактерий и архей для переноса электронов в мембранах используются химически разные хиноны: убихинон, пластохинон, менахинон, кальдареллахинон и другие (рис. 17.4). Кроме того, существуют бактерии и археи, не имеющие хинонов вовсе: это ацетогены из клостридий [18]и большинство групп архей-метаногенов. В электрон-транспортной цепи электроны передаются с более слабого окислителя на более сильный. Единственный окислитель, доступный метаногенам, CO 2, слишком слаб, чтобы принимать электроны с хинонов. Лишь у архейного семейства метаногенов Methanosarcinales есть аналоги хинонов – метанофеназины, которые по своему редокс-потенциалу могут отдавать электроны на CO 2.
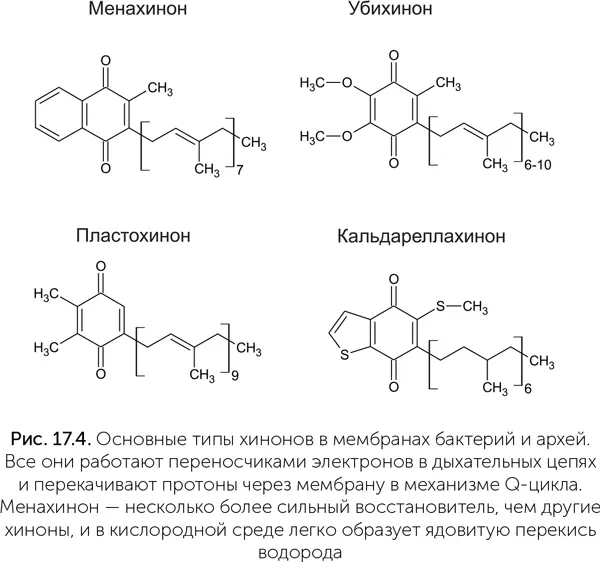
Если посмотреть распределение разных хинонов по филогенетическому дереву бактерий и архей, то легко можно увидеть, что большинство хинонов появились в эволюции после расхождения основных групп бактерий. Убихинон возник у протеобактерий, пластохинон – у цианобактерий, а кальдареллахинон – у архей Sulfolobales . Менахинон же распространен у самых разных групп бактерий и архей. Обладатели уби-, пласто– и кальдареллахинона обычно используют кислород либо устойчивы к нему, а организмы с менахиноном, как правило, строгие анаэробы. Менахинон реагирует с кислородом, образуя ядовитую перекись водорода, поэтому с появлением кислорода в атмосфере разные группы бактерий и архей независимо друг от друга нашли ему безопасную замену. Менахинон в настоящее время найден у самых разных групп анаэробных бактерий и архей, в том числе древних. Вероятно, он был еще у LUCA либо возник вскоре после разделения бактерий и архей.
Разнообразие электрон-транспортных цепей
В предыдущих главах мы познакомились с двумя самыми распространенными вариантами электрон-транспортных цепей, работающими в аэробном дыхании и в кислородном фотосинтезе. На самом деле разнообразие гораздо шире, потому что бактерии и археи используют множество разных окислителей и восстановителей (см. главу 16). Кроме упомянутых в прошлой главе окислителей (кислород, сульфат, нитрат, нитрит) разные бактерии могут использовать серу, хлорат, перхлорат, арсенат, селенат, растворенное трехвалентное железо (в кислой среде), твердые оксиды Fe 2O 3и MnO 2, хлорорганические соединения и другие вещества. В качестве восстановителей может использоваться такая экзотика, как фосфит, арсенит, соединения сурьмы и даже урана. Более того, существуют разные неродственные варианты ферментных комплексов для одной и той же реакции. Например, для окисления железа у разных микробов известно четыре разных ферментных системы. Описание всего этого разнообразия заняло бы целую книгу, поэтому мы ограничимся здесь разбором двух электрон-транспортных цепей: денитрификации и сульфатного дыхания/окисления серы. Первая интересна тем, что некоторые ее ферменты эволюционно родственны ферментам кислородного дыхания, а вторая, по-видимому, одна из древнейших.
Читать дальшеИнтервал:
Закладка:







