Александр Смирнов - Фармакология взаимодействия регуляторных пептидных систем головного мозга в механизмах подкрепления
- Название:Фармакология взаимодействия регуляторных пептидных систем головного мозга в механизмах подкрепления
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2020
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Смирнов - Фармакология взаимодействия регуляторных пептидных систем головного мозга в механизмах подкрепления краткое содержание
Фармакология взаимодействия регуляторных пептидных систем головного мозга в механизмах подкрепления - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Кроме того, изменения в GHS-R1A и про-грелиновых генах были связаны с высоким уровнем потребления алкоголя, курением и увеличением прироста массы людей с алкогольной зависимостью , также как при булимии и ожирении. Таким образом, система грелина учавствует в механизмах подкрепления, а агенты, которые прямо или косвенно подавляют эту систему, рассматриваются в качестве потенциальных лекарственных препаратов для подавления переедания, приводящего к ожирению и лечения наркотической зависимости (Suzanne L. Dickson et al., 2011).
Грелиновая система рассматривается как важная составляющая ЦНС для контроля за питанием (Wren et al., 2000) и энергетического баланса (Lell et al., 2001; Tschop et al., 2000). Рецепторы грелина GHS-R1A представлены в некоторых участках мозга, которые включают: гипоталамус, область покрышки, гиппокамп и ствол ГМ (Guan et al., 1997; Howard et al., 1996; Zigman et al., 2006). Интересно, что эти рецепторы имеют конституциональную активность даже при отсутствии грелиновых лигандов (Holst et al., 2003; Holst and Schwartz., 2004). Из этого следует, что работа рецепторов зависит не только от внутремозговых сигналов, обеспеченных грелином. Более того, работа GHR-R1A может быть подавлена не только через фармакологические антагонисты грелиновых эффектов, но также независимо от грелина (например через использование противоположных агонистов) (Mokrosinski and Holst., 2010).
Заинтересованность в GHS-R1A как в мишени для лечения появилась в 1980х годах, когда пептид, называвшийся пептид 6 релизинг-гормон роста (GHRP-6), каноничный представитель класса синтетических молекул, известных как секретируемый гормон роста (GHS), был определен как сильнейший стимулятор гипоталамо-гипофизарных осей роста (Bowers et al., 1984). Рецепторы к этим лигандам, GHR-R1A, были впервые описан несколько лет спустя группой MerckandCo (Howard et al., 1996).
Вскоре после исследования грелина, как первого эндогенного лиганда для GHS-R1A (Kojima et al., 1999), стало ясно что эти рецепторы также являются потенциальной цель для контроля за приемом пищи и ожирением. На грызунах инъекции грелина (периферически или центрально) вызывали быстрый орексиновый ответ (Asakawa et al., 2001; Wren et al., 2000). Также было найдено, что хроническая стимуляция рецепторов грелином (Tschop et al., 2000) или синтетически выращенными гормонами (Lall et al., 2001) повышала массу тела у грызунов. Уровни грелина повышаются перед приемом пищи (Cummings et al., 2001) и была показана корреляция со степенью голода у здоровых особей (Cummings et al., 2004) определяющяя то, что, по крайней мере в нормальной физиологии, острые изменения грелина, как изменяющегося гормона голода, могут участвовать в формировании решения к употреблению пищи.
В экспериментальных исследованиях на грызунах были определены возможные зоны действия грелина в ГМ: дугообразное ядро, вентромедиальное ядро, дорсомедиальное ядро, паравентрикулярное ядро, латеральный гипоталамус (Olszewski et al., 2003 a,b; Wren et al., 2001 a,b), ядра одиночного тракта ствола мозга (Faulconbridge et al., 2003), центральное ядро миндалины (Olszewski et al., 2003), вентральная область покрышки (VTA) и прилежащее ядро (Egecioglu et al., 2010; Naleid et al., 2005).
Изучая механизмы награды, как ключевые цели для грелина, становится ясно что центральная система грелина необходима для развития наркотической зависимости (Jerlhag et al., 2009; Kaurand, Ryabinin, 2010; Tessari et al.,2007; Wellman et al.,2005 ), а грелиновый рецептор, GHS-R1A, является важной терапевтической мишенью при аддиктивном поведении.
Мезолимбические дофаминовые пути из вентральной области покрышки в прилежащее ядро, которые играют важную роль в побудительной мотивации (желании) (Berridge and Robinson, 2003), являются важным компонентом грелин-опосредованной системы. Грелиновые рецепторы, представленные в вентральной области покрышки (Guan et al., 1997; Zigman et al., 2006), включают субпопуляцию дофаминовых клеток в этой области (Abizaid et al., 2006). Воздействие грелина на вентральную область покрышки активирует и повышает высвобождение дофамина, а также активирует локомоторную стимуляцию (Jerlhag et al., 2006a, 2007) и снижение захвата дофамина в N.Acc. (Abizaid et al., 2006). Периферически введенный грелин также стимулирует мезолимбическую дофаминовую систему (Jerlhag, 2008; Quartaetal., 2009).
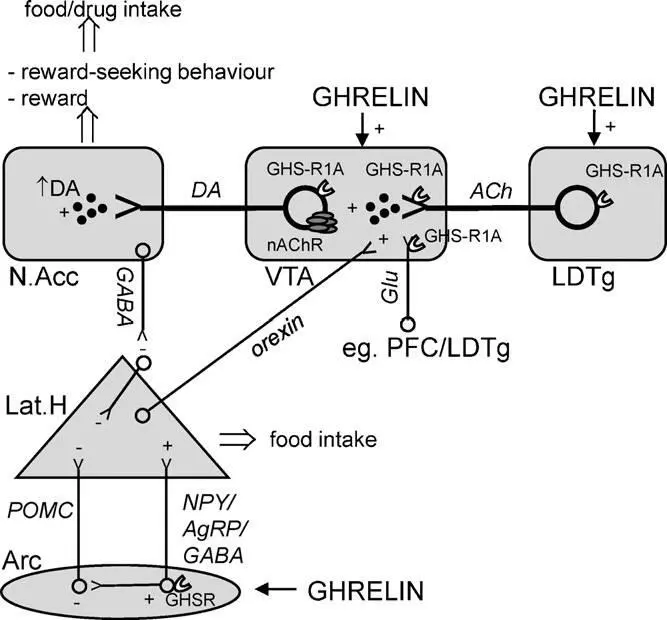
Схематичное изображение ключевых путей, через которые грелин регулирует пищевое поведение и поиск награды
Считается что грелин может иметь прямое влияние на узел подкрепления в LDTg (Guan et al., 1997) через GHS-R1A рецепторы, особенно выраженные на холинергических клетках (Dickson et all., 2010). Мы заметили, что локальное воздействие грелином в LDTg активирует показатели связанные с подкреплением, а именно локомоторную стимуляцию и высвобождение дофамина (Jerlhag et al., 2007). Более того, эти эффекты грелина были блокированы периферическим или интра-VTA воздействием неселективного холинергического никотинового антагониста, мекамиламином (Jerlhag et al., 2006a, 2008). К тому же, периферическая инъекция мекамиламина показала возможность блокирования грелина, локально воздействуя в VTA, чтобы повысить потребление пищи (Dickson et al., 2010). Совместно, эти исследования демонстрируют что грелин активирует холинергическо-дофаминергическую цепочку подкрепления, и таким образом может учавствовать в механизмах подкрепления.
В дальнейшем, с использованием селективного фармакологического антагониста субтипов никотиновых ацетилхолиновых рецепторов было показана способность грелина активировать холинергическо-дофаминергическую цепочку подкрепления опосредовано через особые субтипы никотиновых ацетилхолиновых рецепторов, а именно a3B2*, a6* и В3* (Jerlhag et al., 2008). Интересно, что эти субтипы также опосредуют подкрепляющие способности алкоголя и собственно потребление алкоголя грызунами (Ericson et al., 2009; Jerlhag et al., 2006b; Larsson and Engel, 2004; Lof et al., 2007; Steensland et al., 2007). Эти данные доказываются клиническими исследованиями; таким образом, блокируя эти субтипы рецепторов, возможно снижение употребляемой дозы (McKee et al., 2009).
Кроме того, было показано, что чрезмерное потребление алкоголя в длительный период времени, вызывает выброс ацетилхолина в VTA, следующий за повышением уровня прилежащего дофамина, доказывая, что алкоголь, как и грелин, активирует холинергическо-дофаминергическую цепочку подкрепления (Larsson et al., 2005). Анализирую полученные данные, возникают нейрохимические аналогии между грелином и алкоголем, где холинергическо-дофаминергическая цепочка подкрепления является главным регулятором.
Действие дофаминергических нейронов в VTA обеспечивается через различные афференты и, в пределах VTA, GHS-R1A представлены не только дофаминергическими клетками, но также пресинаптическими афферентами (Abizaid et al., 2006) которые могут обеспечивать способность грелина активировать систему награды. Особенно заметна возможность грелина повышать локомоторную активность, выброс прилежащего дофамина в условиях предпочтения места (совмесное воздействие подкрепления с грелин-парной средой), которая ослаблялась неселективными антагонистами глутамат NMDA рецепторов (AP5) (Jerlhag et al., 2011). Супрессия GHS-R1A уменьшает подкрепляющие свойства алкоголя и соответственно снижает потребление алкоголя у мышей (Jerlhag et al., 2009), а воздействие антагонистов GHS-R1A снижает подкрепляющие возможности амфетамина и кокаина (Jerlhag et al., 2010). Клинические данные также говорят о роли GHS-R1A в регуляции потребления наркотиков (Landgren et al., 2008, 2010). Интересен тот факт, что ограничение пищи, которое повышает уровень грелина (Gualillo et al., 2002), увеличивает кокаино- и амфетаминоиндуцированную локомоторную стимуляцию, увеличивает поиск кокаина и самостимуляцию от какоина или амфетамина у крыс (Carroll et al., 1979).
Читать дальшеИнтервал:
Закладка:




![Андрей Ангелов - Covid головного мозга [ноябрь]](/books/1145589/andrej-angelov-covid-golovnogo-mozga-noyabr.webp)




