Михаил Левицкий - Карнавал молекул. Химия необычная и забавная
- Название:Карнавал молекул. Химия необычная и забавная
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2019
- Город:Москва
- ISBN:978-5-0013-9101-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Левицкий - Карнавал молекул. Химия необычная и забавная краткое содержание
В книге рассказано о некоторых драматичных, а, порой, забавных поворотах судьбы как самих открытий, так и их авторов. Кроме того, читатель потренируется в решении занятных задач, что особенно приятно, когда рядом помещена подсказка, а потом и сам ответ.
В отличие от учебника в книге нет последовательного изложения основ химии, поэтому ее можно читать, начиная с любой главы.
Карнавал молекул. Химия необычная и забавная - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Вот пример реакции по второму варианту – взаимодействие оксида кальция с водой (гашение извести): CaO + H2O == Ca(OH)2. Из двух соединений получается одно, т. е. энтропия уменьшается, но зато реакция при комнатной температуре идет с сильным разогревом (экзотермическая), энергетический фактор пересиливает энтропийный, реакция становится возможной.
Существуют реакции и по третьему варианту – это получение негашеной извести: CaCO3 = CaO + CO2. Расчет показывает, что реакция эндотермическая. Как мы знаем, при комнатной температуре она не идет; обычный мел спокойно хранится, не разлагаясь. Однако реакцию провести можно, поскольку в результате ее увеличивается энтропия (из одного соединения получаются два). Ранее было сказано, что при сопоставлении двух сравниваемых величин энтропийный фактор умножают на абсолютную температуру. Таким образом, мы можем увеличивать роль энтропийного фактора, повышая температуру. При 830 °С обе величины сравняются, а при дальнейшем повышении температуры реакция пойдет в нужном нам направлении, т. е. энтропийный фактор перетянет и мел превратится в негашеную известь СаО.
Все, о чем было рассказано выше, можно считать введением в термодинамику – науку о превращении энергии, но все же остался нерешенным вопрос: что делать с невозможной реакцией и при чем здесь акулы и рыбы-прилипалы?
Сделать невозможное возможным
Итак, реакция, показанная в самом начале нашего рассказа, термодинамически запрещена, тем не менее осуществить намеченное превращение можно, если воспользоваться обходным путем. Знающий химик предложит такую последовательность реакций:
● 1-я стадия – бромирование метана.
● 2-я стадия – получение магнийорганического соединения (реакция Гриньяра), когда атом Mg встраивается между атомами С и Br.
● 3-я стадия – взаимодействие магнийорганического соединения с СО2, при этом происходит встраивание СО2 между атомами С и Mg.
● 4-я стадия – взаимодействие соединения, полученного на третьей стадии, с HBr. В итоге образуется уксусная кислота и побочный продукт – MgBr2 (рис. 2.60).
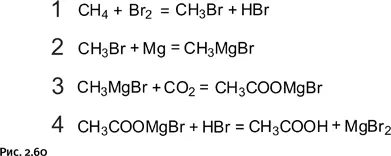
Схема несколько громоздкая, но зато все реакции реально осуществимы, и расчеты показывают, что они термодинамически разрешены. Окончательная ясность возникает, если все четыре стадии просуммировать, вычеркнув (или, как говорят математики, сократив) те соединения, которые присутствуют в правой и левой частях уравнений в одинаковых количествах, а затем представить оставшиеся (не зачеркнутые) реагенты в виде уравнения (рис. 2.61).
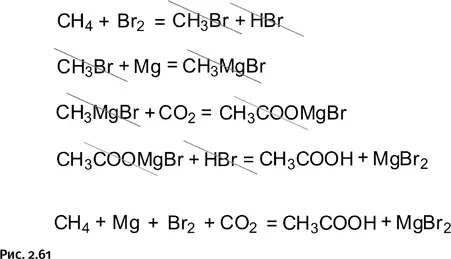
Полученное в результате суммирования окончательное уравнение нагляднее будет представить в виде двух реакций (рис. 2.62). Первая реакция – та, с которой мы начали наш рассказ, а вторая – взаимодействие магния и брома с образованием бромида магния. Ее экзотермичность весьма высока, практически 420 кДж/моль (1 кДж = 1000 Дж), что с лихвой перекрывает и эндотермичность первой реакции, а также то, что в каждой из двух реакций энтропия уменьшается (из двух соединений получается одно). Именно вторая реакция играет роль мощной акулы, которая везет на себе слабенькую рыбу-прилипалу, т. е. термодинамически невозможную реакцию. Энергия, выдаваемая этой «акулой», постепенно расходуется на каждой из четырех стадий.

Итак, на примере того, как удалось осуществить невозможную реакцию, мы познакомились с умением химиков обходить запреты, налагаемые законами природы.
3
Вечная забота химика
Забота государства о людях
познается по районным поликлиникам.
МИХАИЛ ЗАДОРНОВХимик постоянно занимается тем, что «ставит» различные реакции, именно так и говорят – не «осуществить» или «провести», а «поставить». Во-первых, важно, чтобы реакция «пошла», а если идет слишком медленно, то хорошо бы ее убыстрить. Обе эти задачи успешно решает удачно найденный катализатор. Это вещество, добавленное в реакционную смесь, ускоряет процесс, но само при этом не расходуется. Например, выберем случай, когда вещества А и Б не реагируют или реагируют очень медленно (рис. 3.1).
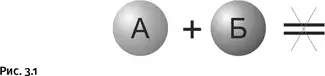
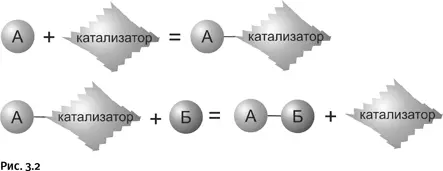
Ситуацию может исправить катализ: вещество А реагирует вначале с катализатором, образуя некое «временное соединение» – так называемый переходный комплекс А – катализатор. Затем этот комплекс реагирует с веществом Б, образуется нужное соединение А – Б, а катализатор высвобождается и может далее принимать участие в образовании следующей молекулы А – Б (рис. 3.2).
Все эти представления о катализе, рассказанные буквально в четырех строках, возникли далеко не сразу. В 90-х гг. XVIII в. французские химики Никола Клеман и Шарль Бернар Дезорм изучали процесс получения серной кислоты окислением серы. Образующийся при сжигании серы диоксид SO 2необходимо окислить до серного ангидрида SO 3, который при растворении в воде образует серную кислоту H 2SO 4. В качестве «передатчика» кислорода диоксиду серы были использованы оксиды азота. При этом ученые отметили, что количество оксидов азота в ходе процесса не изменяется. Это было первое описание каталитического процесса.
Постепенно количество наблюдаемых реакций, ускорение которых происходило в присутствии различных веществ, увеличивалось. В 1811 г. российский химик К.С. Кирхгоф открыл реакцию превращения крахмала в глюкозу в присутствии кислоты, количество которой в ходе реакции существенно не уменьшалось. Французский химик Луи Жак Тенар описал в 1818 г. распад аммиака NH 3, а также перекиси водорода на некоторых металлах и оксидах, которые при этом не претерпевают никаких изменений. Г. Дэви и И.В. Деберейнер, проведя в 1816–1821 гг. серию исследований, установили, что порошкообразная платина многократно ускоряет присоединение водорода к кислороду, а также окисление органических соединений кислородом.
Шведский химик Й.Я. Берцелиус (рис. 3.3) сумел разглядеть в этих, казалось бы, несхожих работах нечто общее, и в 1835–1836 гг. он опубликовал серию обобщающих работ, назвав наблюдаемое явление катализом (от греч. κατάλυσις – разложение).

Научные основы катализа заложил немецкий химик В. Оствальд (рис. 3.4), получивший в 1909 г. Нобелевскую премию по химии «за работы по катализу, а также за исследования основных принципов управления химическим равновесием и скоростями реакции». Он определил катализатор как «вещество, которое изменяет скорость реакции, не появляясь в конечном продукте реакции». Для оценки каталитического действия Оствальд предложил измерять скорости реакций. Фактически он создал новую дисциплину – кинетику, т. е. раздел химии, изучающий скорости реакций.
Читать дальшеИнтервал:
Закладка:









