Михаил Левицкий - Карнавал молекул. Химия необычная и забавная
- Название:Карнавал молекул. Химия необычная и забавная
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2019
- Город:Москва
- ISBN:978-5-0013-9101-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Левицкий - Карнавал молекул. Химия необычная и забавная краткое содержание
В книге рассказано о некоторых драматичных, а, порой, забавных поворотах судьбы как самих открытий, так и их авторов. Кроме того, читатель потренируется в решении занятных задач, что особенно приятно, когда рядом помещена подсказка, а потом и сам ответ.
В отличие от учебника в книге нет последовательного изложения основ химии, поэтому ее можно читать, начиная с любой главы.
Карнавал молекул. Химия необычная и забавная - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Угольную кислоту Н 2СО 3как индивидуальное соединение удалось получить при нагревании в высоком вакууме бикарбоната аммония (рис. 4.1).
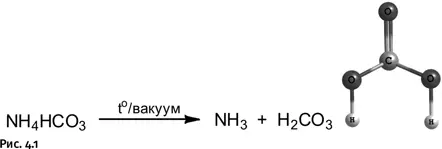
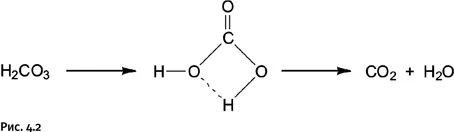
Стабильность чистой H 2CO 3достаточно высока, она может возгоняться в вакууме, но ее разложение при нагревании все же возможно. При любом превращении реагирующие молекулы вначале образуют некое промежуточное соединение (так называемый переходный комплекс), которое затем распадается, образуя продукты реакции. Образование комплекса требует затрат энергии. Чем меньше эта энергия, тем легче проходит реакция. Разложение угольной кислоты при нагревании проходит через циклический переходный комплекс, образуемый четырьмя атомами О-С-О-Н. Цикл возникает благодаря так называемой водородной связи между атомами О и Н (на рис. 4.2 показана пунктиром): Энергия образования такого комплекса 184 кДж/моль.
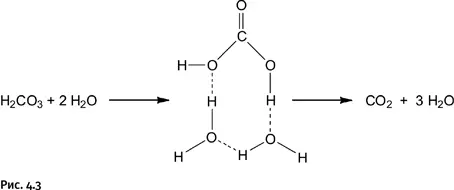
В присутствии воды, т. е. при обычном способе получения угольной кислоты, легко образуется восьмичленный переходный комплекс с помощью тех же водородных связей при участии одной молекулы угольной кислоты и двух молекул Н 2О. Энергия образования такого комплекса почти вдвое меньше, 100 кДж/моль, и разложение проходит очень быстро (рис. 4.3).
Возможность существования угольной кислоты в свободном виде не только интересна, но и важна, это открытие позволило по-новому взглянуть на процесс дыхания. Полагают, что в живом организме угольная кислота, «оберегаемая» от разложения специальным ферментом, позволяет осуществлять быстрый перенос углекислого газа из клеток в кровь, а затем мы его выдыхаем через легкие.
Поскольку свободная угольная кислота получена и, естественно, изучен ее спектр, астрономы полагают, что теперь она может быть спектрально обнаружена в атмосфере планет Солнечной системы.
Полувековая иллюзия
Все иллюзия.
Конечно, и предыдущая фраза.
СТАНИСЛАВ ЕЖИ ЛЕЦС момента открытия в конце XIX в. благородных газов (He, Ne, Ar, Kr, Xe) они считались химически абсолютно пассивными и не способными вступать в какие-либо реакции, поэтому их назвали инертными. Такая точка зрения продержалась вплоть до 1962 г., однако в результате работ канадского ученого Нила Бартлетта (рис. 4.4) эти представления пришлось пересматривать.

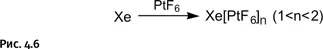
Изучая соединение платины с фтором PtF 6, Бартлетт обратил внимание на сильнейшие окислительные способности этого соединения, оно способно окислять даже молекулярный кислород, который сам хороший окислитель. В результате получается соединение, в котором у кислорода изъят один электрон и он получает положительный заряд O 2 +[PtF 6] –. Бартлетту пришла в голову интересная мысль: если гексафторид платины может оторвать электрон от кислорода, то он может проделать то же самое с ксеноном, поскольку, как уже было известно, для этого требуется несколько меньшая энергия, чем в случае кислорода. В результате опыта он получил сразу несколько химических соединений переменного состава, содержащих ксенон (рис. 4.5 и 4.6).
Это сообщение сразу привлекло внимание химиков. Оказалось, что фторировать ксенон можно и без участия платины действием элементарного фтора. Так были получены XeF 4и XeF 6. Фтор настолько сильный окислитель, что способен отрывать электроны даже от устойчивой восьмиэлектронной оболочки инертного газа. На этом исследователи не остановились, удалось даже получить кислородные соединения ксенона, например XeO 3. Таким образом миф, утверждавший абсолютную инертность благородных газов, удалось разрушить. Возникло не только новое направление в химии, это открытие привело к пересмотру некоторых фундаментальных представлений. Нулевую группу в периодической системе упразднили, а благородные газы поместили в VIII группу, т. е. туда, где находятся малоактивные благородные металлы палладиевой и платиновой групп.
Прокатиться на реакции
Хорошо кататься по российским просторам
на импортном внедорожнике, плохо только,
что попадаются дороги.
СТАС ЯНКОВСКИЙИногда случается так, что разрозненные факты, если их объединить, могут указать новое направление исследований. Рассмотрим, как археологические изыскания и обычные бытовые наблюдения привели к пониманию нового явления.
Бывает ли самородный алюминий?
Самородный – значит такой, который встречается в природе в чистом виде, а не в составе химического соединения. Алюминий – один из наиболее активных химических элементов, потому в земной коре он присутствует в виде оксида Al 2O 3либо в составе различных силикатов, причем в гигантских количествах. Впервые металлический алюминий получил датский физик Xанс Кристиан Эрстед в 1825 г., воздействуя ртутной амальгамой калия на хлорид алюминия, после чего ртуть отгонялась. Такой алюминий ценился дороже золота. В 1889 г. Д.И. Менделееву во время пребывания его в Лондоне в знак уважения преподнесли весы, одна чаша которых была сделана из золота, а другая – из драгоценного алюминия. Промышленное производство алюминия электролизом расплавленных солей началось в конце XIX в.
Существование самородного металлического алюминия в природе казалось немыслимым – даже в химической энциклопедии сказано, что он в свободном виде не встречается. Первое сомнение внесли археологи, причем их открытия сопровождались драматическими спорами, разжигавшими воображение.
В 1952 г. в провинции Цзянсу (Китай) было обнаружено захоронение китайского полководца Чжоу Чу, жившего во II в. до н. э. В 1953 г. начались раскопки, во время которых было найдено около 20 металлических предметов, предположительно представлявших собой детали пояса (рис. 4.7).
Анализ одного из фрагментов, проведенный на химическом факультете Нанкинского университета, продемонстрировал, что образец содержит 85 % алюминия. Это факт казался невероятным. Как могли получить металлический алюминий в столь древние времена? Тем не менее результаты анализа подтвердили в Научно-исследовательском институте прикладной физики Китайской академии. Это открытие горячо поддержала общественность, поскольку оно дополнительно подтверждало высокое развитие цивилизации Китая в древние времена. Далее события стали развиваться драматически. Другой фрагмент пояса был отправлен для анализа в Северо-Восточный инженерный колледж Китая. Результаты анализа не подтвердили наличие алюминия в этом фрагменте, он состоял на 90–95 % из серебра. Поскольку этот результат бросал тень на столь важное для истории Китая открытие, его закрыли для публикации (на пять лет). К исследованиям подключились ученые из Университета Цинхуа, проведя анализ еще одного фрагмента, они подтвердили высокое содержание алюминия. В итоге был сделан вывод, что большинство фрагментов пояса сделаны из серебра, а некоторые – из алюминия. Попутно возникло предположение, что алюминиевые фрагменты занесены расхитителями гробниц еще до научных раскопок. Этот вариант с иронией был отвергнут учеными: трудно представить себе грабителей, которые принесли с собой тщательно изготовленные алюминиевые фрагменты, покрыли их вековой пылью, но не унесли серебро. Может быть, они хотели запутать будущих археологов и добавить дополнительный блеск к истории Китая?
Читать дальшеИнтервал:
Закладка:









