Михаил Левицкий - Карнавал молекул. Химия необычная и забавная
- Название:Карнавал молекул. Химия необычная и забавная
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2019
- Город:Москва
- ISBN:978-5-0013-9101-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Левицкий - Карнавал молекул. Химия необычная и забавная краткое содержание
В книге рассказано о некоторых драматичных, а, порой, забавных поворотах судьбы как самих открытий, так и их авторов. Кроме того, читатель потренируется в решении занятных задач, что особенно приятно, когда рядом помещена подсказка, а потом и сам ответ.
В отличие от учебника в книге нет последовательного изложения основ химии, поэтому ее можно читать, начиная с любой главы.
Карнавал молекул. Химия необычная и забавная - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
На объемной шаростержневой модели видно, что они по форме напоминают корону, поэтому их назвали краун-эфирами (от англ. crown – корона). Слово «эфир» в названии этих соединений не случайно: фрагмент – С – О – С– называют простой эфирной связью.
Внутри циклов имеется пустое пространство, куда охотно помещается катион щелочного металла и удерживается за счет полярных взаимодействий. У показанных циклов размер внутренней полости различен, причем для цикла с четырьмя атомами кислорода «отверстие» точно совпадает с размером катиона лития Li+, поэтому такой катион прочно удерживается этим краун-эфиром. На шаростержневой модели это не так очевидно, но если изобразить молекулу с ван-дер-ваальсовыми радиусами (они показывают истинное пространство, занимаемое атомами), то отчетливо видно, каким образом катион удерживается циклом (рис. 4.19).
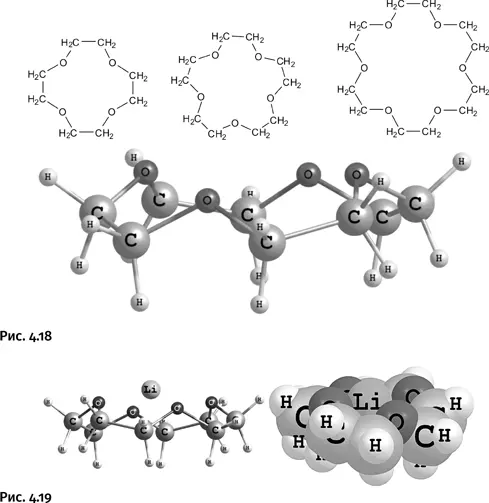
Цикл с пятью атомами кислорода охотно принимает катион Na +, а в цикле с шестью атомами О с удовольствием располагается катион К +.
Краун-эфиры сразу же вошли в лабораторную практику, с их помощью можно растворять неорганические соли в органических средах. Например, можно растворить в бензоле NaCl, но гораздо интереснее то, что удалось перевести в органический раствор мощные неорганические окислители: так появились малиновый бензол (раствор перманганата калия), оранжевый бензол (раствор бихромата калия) и т. д. Краун-эфиры стали использовать для разделения, очистки и регенерации металлов, в том числе редкоземельных; в качестве лекарственных препаратов и как катализаторы для реакций с участием анионов. Последнее из упомянутых применений особенно эффективно: когда катион прочно связан, освободившийся анион становится весьма активным.
Антикрауны
Если существуют циклические молекулы, способные удерживать катионы, то почему бы не создать соединения, захватывающие анионы? В краун-эфирах катион щелочного металла координационно удерживается атомами кислорода, несущими частичный отрицательный заряд. Следовательно, антикраун должен представлять собой цикл из атомов с положительным зарядом. Такую идею удалось реализовать профессору В.Б. Шуру из Института элементоорганических соединений Российской академии наук.
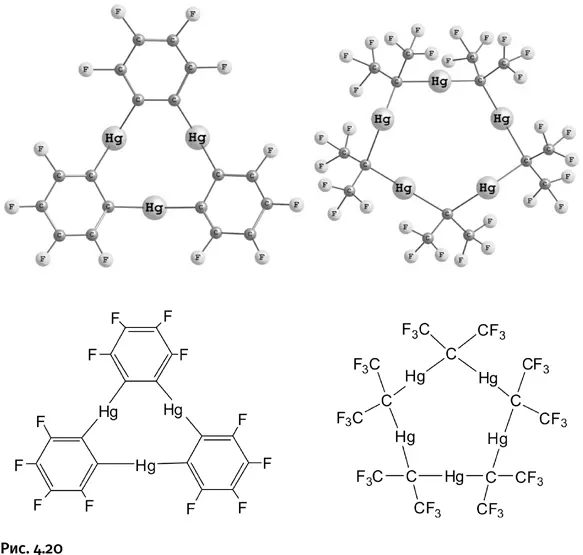
Экспериментальные поиски привели к двум удачным циклическим структурам, в которых основную роль играют атомы ртути (рис. 4.20).
Обе молекулы «окружены» атомами фтора, это не случайно, они оттягивают на себя электронную плотность, увеличивая координирующую способность атомов Hg. Несмотря на то что на зубчатую корону эти циклы не похожи (они плоские), им дали название «антикрауны», поскольку их действие противоположно тому, которое наблюдают в краун-эфирах. Окончание «эфир» тоже исчезло, поскольку в антикраунах отсутствует эфирная связь.
Здесь произошла забавная игра названий. Автор этих структур, российский химик В.Б. Шур, предложил название «антикрауны», что кажется вполне логичным, и в его публикациях, напечатанных в англоязычных журналах, этот термин в точном переводе выглядит так – anticrown. Но это слово в английском языке переводится дословно «против короны» и используется для обозначения массовых движений антимонархистов в некоторых странах Европы (где существует монархия).
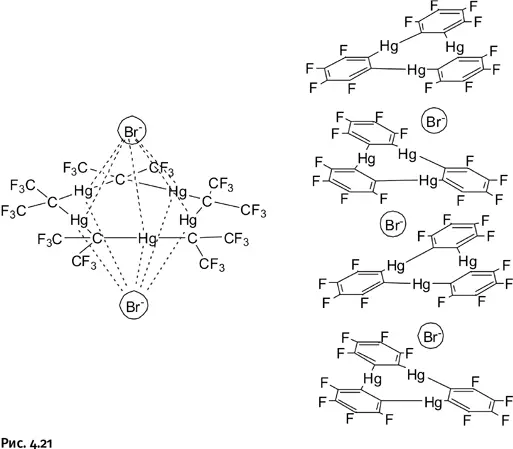
Оказалось, что эти Hg-содержащие циклы обладают сильно выраженной способностью захватывать анионы, например Cl –, Br –, I –и др. Размер внутренней полости у них невелик, много места занимают объемные атомы ртути, поэтому крупные анионы внутрь цикла не входят (в отличие от того, как это было у краун-эфиров). Они располагаются над и под циклом, т. е. захватываются сразу два аниона, иногда такие «бутерброды» складываются в протяженные стопки (на рис. 4.21 координационные связи показаны пунктиром только для одного аниона Br –, чтобы не перегружать изображение).
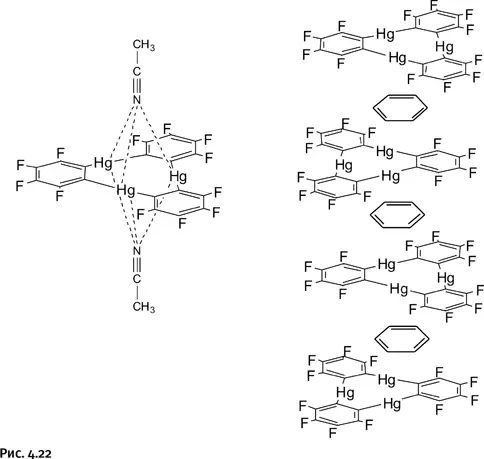
Антикрауны способны даже захватывать нейтральные молекулы, такие как ацетонитрил CH 3C≡N (удерживаются сразу две молекулы) или бензол, который образует с антикрауном вертикальную колонну из чередующихся слоев (рис. 4.22).
Комплексы антикраунов с некоторыми ароматическими соединениями образуют флуоресцирующие композиции, что открывает перспективы создания на их основе сенсорных (т. е. чувствительных) устройств. По аналогии с обычными краун-эфирами антикрауны, захватывая анион, повышают активность освободившегося катиона, что представляет интерес для катализа. Это удалось подтвердить: экспериментально было показано их каталитическое действие при нитровании ароматических соединений.
Самая сильная кислота
Потребность необычайного,
может быть, самая сильная из потребностей.
АЛЕКСАНДР ГРИНВ соответствии со старинным определением, которое хорошо работает и в наши дни, кислота – это соединение, которое способно отдавать протон Н +; чем легче это происходит, тем сильнее кислота. Силу обычных неорганических кислот оценивают по тому, насколько полно они распадаются в водном растворе на ионы Н +и А –(А – анион кислоты). Сразу отметим, что существуют кислоты, не содержащие протонов (льюисовы кислоты, о которых рассказано в главе «Создавать затруднение полезно»), но мы сосредоточим внимание только на протонных кислотах.
В 30-х гг. ХХ в. появились так называемые суперкислоты, например фторсульфоновая FS(O) 2ОH и трифторметансульфоновая F 3CS(O) 2ОH (рис. 4.23).
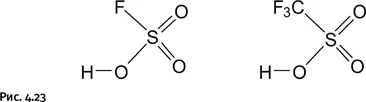
Атомы фтора энергично оттягивают на себя электронную плотность, что заметно облегчает отделение протона Н +от молекулы кислоты, и он становится значительно более активным. С помощью таких кислот удалось ввести катион (т. е. протон) в органические соединения, например в углеводороды, в результате возникла химия карбкатионов – соединений, содержащих положительный заряд на углеродном атоме С +(рис. 4.24).
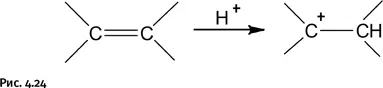
Такие соединения в свою очередь помогли понять механизм многих превращений в органической химии и, кроме того, открыли способы наращивания углеводородной цепи.
Читать дальшеИнтервал:
Закладка:









