Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Для экзотермической реакции:
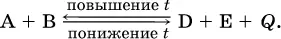
Для эндотермической реакции:
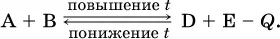
Значение К с обязательно изменится при повышении и понижении температуры, так как значения констант скорости k прямой (→) и обратной (←) реакций по-разному зависят от температуры, ведь это реакции между разными реагентами (соответственно А и В или D и Е). Следовательно, константа равновесия – функция температуры:
Примеры:
а) повышениетемпературы (нагревание):
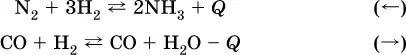
б) понижениетемпературы (охлаждение):
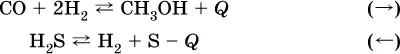
2. Давление. Изменение давления оказывает влияние только на те системы, где хотя бы одно вещество находится в газообразном состоянии (твердые и жидкие вещества не учитываются, так как их собственный объем весьма мал по сравнению с объемом газов и паров).
Увеличениедавления в обратимой реакции смещает равновесие с сторону процесса, идущего с уменьшением количества газообразных веществ, т. е. с уменьшениемобъема, а уменьшение давления – в сторону увеличения количества газообразных веществ, т. е. с увеличениемобъема:
а)
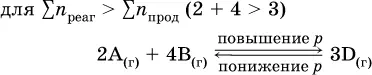
б)
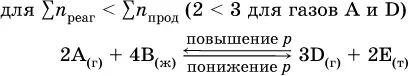
При Σn реаг= Σn продизменение не вызовет смещения равновесия.
Примеры гомогенных реакций:
а) увеличениедавления (сжатие):
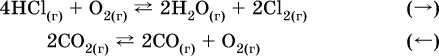
б) уменьшениедавления (расширение):
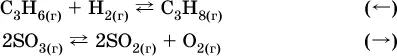
Примеры гетерогенных реакций (коэффициенты перед формулами конденсированных веществ не учитываются):
а) увеличениедавления (сжатие):
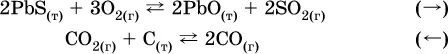
б) уменьшениедавления (расширение):
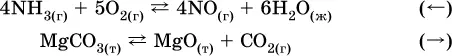
В реакциях с равными количествами газообразных реагентов и продуктов (здесь 2 = 2 в обоих примерах):
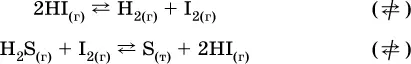
сдвиг равновесия наблюдаться не будет.
3. Концентрация. При увеличенииконцентрации одного из газообразных веществ (реагента или продукта), находящегося в равновесной системе, равновесие смещается в сторону расхода данного вещества. При уменьшенииконцентрации этого вещества равновесие смещается в сторону образованияданного вещества. Изменение содержания твердых и жидких веществ не влияет на состояние равновесия.
Для некоторой реакции:
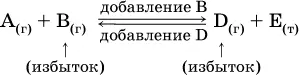
Смещение равновесия вправо можно было вызвать добавлением избытка реагента А (вместо В), а смещение влево возможно только избытком продукта D (другой продукт – твердое вещество).
Этот вывод следует непосредственно из равновесного закона действующих масс:
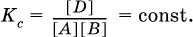
При добавлении в систему газа D равновесие сместится влево т. е. при протекании обратной реакции так увеличится содержание газов А и В, что соотношение концентраций останется постоянным и равным К с. Отметим еще раз, что добавление конденсированного вещества (здесь твердого Е) не повлияет на состояние равновесия (сдвиг равновесия добавлением Е невозможен).
Примеры:
а) при добавлении аммиака равновесие сместится вправо:
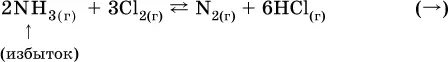
б) при добавлении водорода равновесие сместится влево:
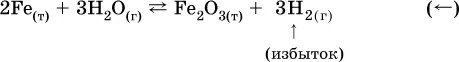
1. Гетерогенные реакции – это
1) Н 2+ I 2(г) → HI
2) Fe 2(SO 4) 3(т) → Fe 2O 3(T) + SO 3
3) Zn + H 2SO 4→ ZnSO 4+ H 2↑
4) CO + H 2→ CO + H 2O (nap)
2. При взаимодействии H 2с Cl 2, Br 2и I 2в сосудах равного объема через 27 с образуется по 0,04 моль продуктов. Скорость реакции
1) выше для I 2
2) выше для Cl 2
3) одинакова
4) выше для Br 2
3. Для гомогенной реакции А + В →… при одновременном увеличении молярной концентрации исходных веществ в 3 раза скорость реакции возрастет
1) в 2 раза
2) в 3 раза
3) в 6 раз
4) в 9 раз
4—6. Скорость реакции
4. 2CuО (т)+ СО →…
5. 2FeO (т)+ С (т)→…
6. N 2+ 2С (т)+ Н 2→…
при V = const и увеличении количества веществ в 4 раза изменится так:
1) возрастет в 4 раза
2) возрастет в 8 раз
3) возрастет в 16 раз
4) не изменится
7—8. Равновесие смещается вправо (→) при
7. нагревании
8. охлаждении реакционных систем
1) 2СО + O 2  2СO 2+ Q
2СO 2+ Q
2) 2HI +  Н 2+ I 2– Q
Н 2+ I 2– Q
3) N 2+ O 2  2NO – Q
2NO – Q
4) 2Н 2+ O 2  2Н 2O + Q
2Н 2O + Q
9. Равновесие реакции этерификации СН 3СООН + С 2Н 5ОН  СН 3СООС 2Н 5+ Н 2O + Q
СН 3СООС 2Н 5+ Н 2O + Q
можно сдвинуть вправо (→)
1) добавлением серной кислоты
2) добавлением едкого натра
3) нагреванием
4) добавлением воды
10. Равновесие в гетерогенной реакции СаО (ст)+ СО 2  СаСO 3(т)+ Q сместится влево (←) при
СаСO 3(т)+ Q сместится влево (←) при
1) добавлении СаО
2) добавлении СаСO 3
3) сжатии
4) нагревании
11. Выход продукта в реакции CaS (т)+ 2O 2  CaSO 4(т)+ Q
CaSO 4(т)+ Q
можно увеличить
1) добавлением CaS
2) нагреванием
Читать дальшеИнтервал:
Закладка:










