Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Известно много веществ (в общем виде МА), которые после растворения в воде и образования гидратов молекул MA nН 2O претерпевают существенные формульные изменения. В результате в растворе появляются гидратированные ионы – катионы М + • nН 2O и анионы А • nН 2O:
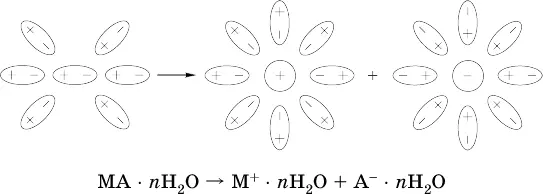
Такие вещества относят к электролитам.
Процесс появления гидратированных ионов в водном раствореназывается электролитической диссоциацией (С. Аррениус, 1887).
Электролитическая диссоциация ионныхкристаллических веществ (М +)(А -) в воде является необратимойреакцией:
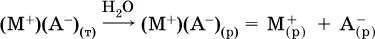
Такие вещества относятся к сильным электролитам, ими являются многие основания и соли, например:
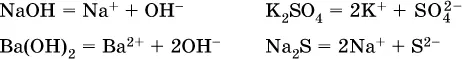
Электролитическая диссоциация веществ MA, состоящих из полярныхковалентных молекул, является обратимойреакцией:
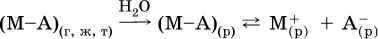
Такие вещества относят к слабым электролитам, ими являются многие кислоты и некоторые основания, например:
а)
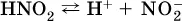
б)
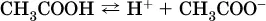
в)
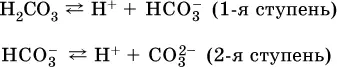
г)
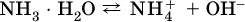
В разбавленных водных растворах слабых электролитов мы всегда обнаружим как исходные молекулы, так и продукты их диссоциации – гидратированные ионы.
Количественная характеристика диссоциации электролитов называется степенью диссоциации и обозначается α [1], всегда α > 0.
Для сильных электролитов α = 1 по определению (диссоциация таких электролитов полная).
Для слабых электролитов степень диссоциации – отношение молярной концентрации продиссоциировавшего вещества (с д) к общей концентрации вещества в растворе (с):
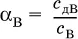
Степень диссоциации – это доля от единицы или от 100 %. Для слабых электролитов α « С 1 (100 %).
Для слабых кислот Н nА степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей:
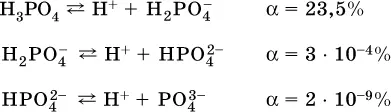
Степень диссоциации зависит от природы и концентрации электролита, а также от температуры раствора; она растет при уменьшенииконцентрации вещества в растворе (т. е. при разбавлении раствора) и при нагревании.
В разбавленных растворах сильных кислот Н nА их гидроанионы Н n-1А не существуют, например:
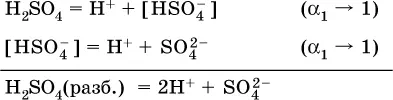
B концентрированныхрастворах содержание гидроанионов (и даже исходных молекул) становится заметным:
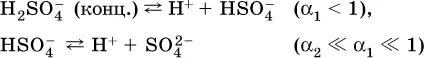
(суммировать уравнения стадий обратимой диссоциации нельзя!). При нагревании значения α 1и α 2возрастают, что способствует протеканию реакций с участием концентрированных кислот.
Кислоты – это электролиты, которые при диссоциации поставляют в водный раствор катионы водорода и никаких других положительных ионов не образуют:
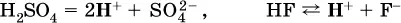
Распространенные сильные кислоты:

В разбавленном водном растворе (условно до 10 %-ного или 0,1-молярного) эти кислоты диссоциируют полностью. Для сильных кислот Н nА в список вошли их гидроанионы(анионы кислых солей), также диссоциирующие полностью в этих условиях.
Распространенные слабые кислоты:
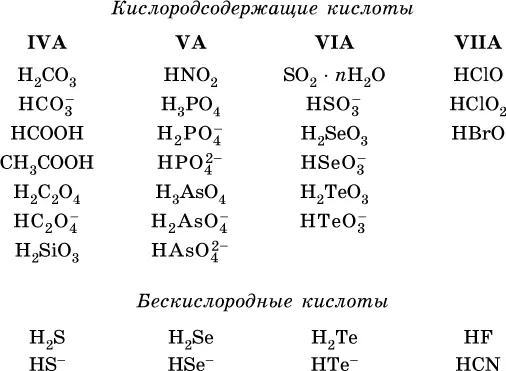
Основания – это электролиты, которые при диссоциации поставляют в водный раствор гидроксид-ионы и никаких других отрицательных ионов не образуют:
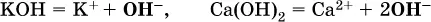
Диссоциация малорастворимыхоснований Mg(OH) 2, Cu(OH) 2, Mn(OH) 2, Fe(OH) 2и других практического значения не имеет.
К сильнымоснованиям ( щелочам) относятся NaOH, КОН, Ва(ОН) 2и некоторые другие. Самым известным слабым основанием является гидрат аммиака NH 3Н 2O.
Средние соли – это электролиты, которые при диссоциации поставляют в водный раствор любые катионы, кроме Н +, и любые анионы, кроме ОН -:
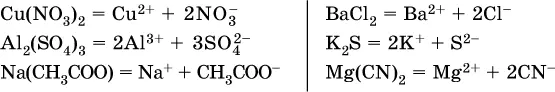
Речь идет только о хорошо растворимых солях. Диссоциация малорастворимыхи практически нерастворимыхсолей значения не имеет.
Аналогично диссоциируют двойные соли:
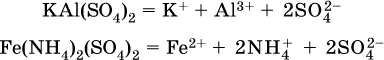
Кислые соли(большинство из них растворимы в воде) диссоциируют полностью по типу средних солей:
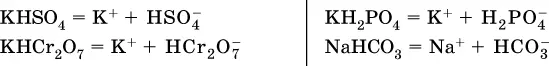
Образующиеся гидроанионы подвергаются, в свою очередь, воздействию воды:
а) если гидроанион принадлежит сильнойкислоте, то он сам диссоциирует также полностью:
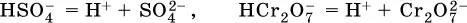
и полное уравнение диссоциации запишется в виде:
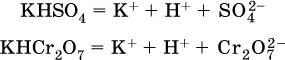
(растворы таких солей обязательно будут кислыми, как и растворы соответствующих кислот);
Читать дальшеИнтервал:
Закладка:










