Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
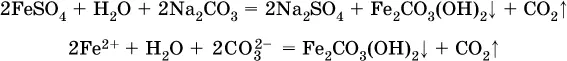
Аналогично FeCO 3, сульфид хрома (III) Cr 2S 3(нерастворимый в воде) не осаждается из раствора:
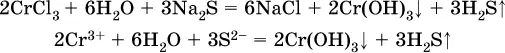
В табл. 15 не указаны также соли, которые разлагаютсяводой — сульфид алюминия Al 2S 3(а также BeS) и ацетат хрома (III) Cr(СН 3СОО) 3:
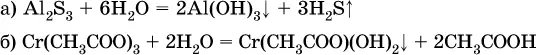
Следовательно, эти соли также нельзя получить по обменной реакции в растворе:
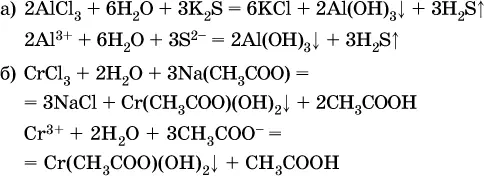
(в последней реакции состав осадка более сложный; подробнее такие реакции изучают в высшей школе).
Примерыреакций с выделением газов:
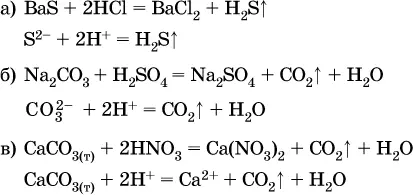
Примерыреакций с образованием слабых электролитов:
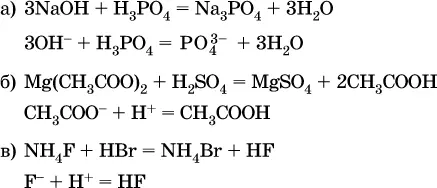
Если реагенты и продукты обменной реакции не являются сильными электролитами, ионный вид уравнения отсутствует, например:
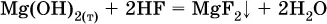
13.5. Гидролиз солей
Гидролиз соли – это взаимодействие ее ионов с водой, приводящее к появлению кислотной или щелочной среды, но не сопровождающееся образованием осадка или газа(ниже речь идет о средних солях).
Процесс гидролиза протекает только с участием растворимыхсолей и состоит из двух этапов:
1) диссоциация соли в растворе – необратимаяреакция (степень диссоциации α = 1, или 100 %);
2) собственно гидролиз, т. е. взаимодействие ионов соли с водой, – обратимаяреакция (степень гидролиза α < 1, или 100 %).
Уравнения 1-го и 2-го этапов – первый из них необратим, второй обратим – складывать нельзя!
Отметим, что соли, образованные катионами щелочейи анионами сильныхкислот, гидролизу не подвергаются, они лишь диссоциируют при растворении в воде. В растворах солей КCl, NaNO 3, Na 2SO 4и BaI 2среда нейтральная.
В случае взаимодействия анионарастворенной соли с водой процесс называется гидролизом соли по аниону.
1)
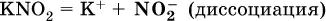
2)
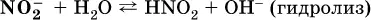
Диссоциация соли KNO 2протекает полностью, гидролиз аниона NO 2– в очень малой степени (для 0,1М раствора – на 0,0014 %), но этого оказывается достаточно, чтобы раствор стал щелочным(среди продуктов гидролиза присутствует ион ОН -), в нем рН = 8,14.
Гидролизу подвергаются анионы только слабыхкислот (в данном примере – нитрит-ион NO 2 -, отвечающий слабой азотистой кислоте HNO 2). Анион слабой кислоты притягивает к себе катион водорода, имеющийся в воде, и образует молекулу этой кислоты, а гидроксид-ион остается свободным:
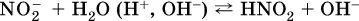
Список гидролизующихся анионов:
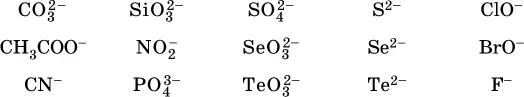
Примеры:
а)
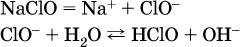
б)
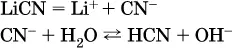
в)
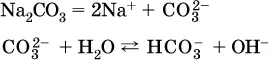
г)
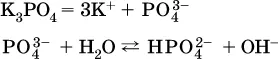
д)
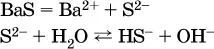
Обратите внимание, что в примерах (в – д) нельзя увеличивать число молекул воды и вместо гидроанионов (HCO 3 -, HPO 4 2-, HS -) писать формулы соответствующих кислот (Н 2СO 3, Н 3РO 4, H 2S). Гидролиз – обратимая реакция, и протекать «до конца» (до образования кислоты Н nА) он не может.
Если бы такая неустойчивая кислота, как Н 2СO 3, образовалась в растворе своей соли Na 2CO 3, то наблюдалось бы выделение из раствора газа СO 2(Н 2СO 3= СO 2↓ + Н 2O). Однако при растворении соды в воде образуется прозрачный раствор без газовыделения, что является свидетельством неполноты протекания гидролиза аниона СО| с появлением в растворе только гидроаниона угольной кислоты HCOg.
Степень гидролиза соли по аниону зависит от степени диссоциации продукта гидролиза – кислоты (HNO 2, НClO, HCN) или ее гидроаниона (HCO 3 -, HPO 4 2-, HS -); чем слабее кислота, тем выше степень гидролиза.Например, ионы СО 3 2-, РО 4 3-и S 2-подвергаются гидролизу в большей степени (в 0,1 М растворах ~ 5 %, 37 % и 58 % соответственно), чем ион NO 2, так как диссоциация Н 2СO 3и H 2S по 2-й ступени, а Н 3РO 4по 3-й ступени (т. е. диссоциация ионов HCO 3 -, HS -и HPO 4 2-) протекает значительно меньше, чем диссоциация кислоты HNO 2. Поэтому растворы, например, Na 2CO 3, К 3РO 4и BaS будут сильнощелочными(в чем легко убедиться по мылкости раствора соды на ощупь). Избыток ионов ОН в растворе легко обнаружить индикатором или измерить специальными приборами (рН-метрами).
Если в концентрированный раствор сильно гидролизующейся по аниону соли, например Na 2CO 3, внести алюминий, то последний (вследствие амфотерности) прореагирует с ОН -
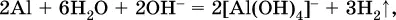
и будет наблюдаться выделение водорода. Это – дополнительное доказательство протекания гидролиза иона СО 3 2-(ведь в раствор Na 2CO 3мы не добавляли щелочь NaOH!).
В случае взаимодействия катионарастворенной соли с водой процесс называется гидролизом соли по катиону:
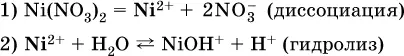
Диссоциация соли Ni(NO 3) 2протекает полностью, гидролиз катиона Ni 2+– в очень малой степени (для 0,1 М раствора – на 0,001 %), но этого оказывается достаточно, чтобы раствор стал кислым(среди продуктов гидролиза присутствует ион Н +), в нем рН = 5,96.
Гидролизу подвергаются катионы только малорастворимых основных и амфотерных гидроксидов и катион аммония NH 4 +. Гидролизуемый катион притягивает к себе анион ОН -, имеющийся в воде, и образует соответствующий гидроксокатион, а катион Н +остается свободным:
Читать дальшеИнтервал:
Закладка:










