Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
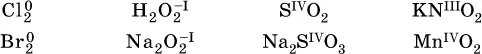
Окислительно-восстановительные свойства веществ связаны с положением элементов в Периодической системе Д. И. Менделеева. Простые вещества – неметаллы обладают бóльшими окислительнымисвойствами, а металлы – бóльшими восстановительнымисвойствами (O 2, Cl 2– окислители; Na, Ва, Al и Zn – восстановители).
В каждой группе Периодической системы элемент с большимпорядковым номером будет обладать и бóльшими восстановительнымисвойствами в своей группе, а элемент с меньшимпорядковым номером – бóльшими окислительнымисвойствами. Так, кальций Са – более сильный восстановитель, чем магний Mg, молекулярный хлор Cl 2– более сильный окислитель, чем иод I 2.
Соединения, содержащие атомы элементов в низкой степени окисления, будут восстановителями за счет этих атомов, например: NH 3– восстановитель за счет азота (-III), H 2S – за счет серы (-II), KI – за счет иода (-I) и т. д.
Соединения, включающие атомы элементов в высокойстепени окисления, будут окислителями, например: HNO 3– окислитель за счет азота (+V), КMnO 4– за счет марганца (+VII), К 2Cr 2O 7– за счет хрома (+VI) и т. д.
14.2. Подбор коэффициентов методом электронного баланса
Метод состоит из нескольких этапов.
1. Записывают схемуреакции; находят элементы, повышающие и понижающие свои степени окисления, и выписывают их отдельно:
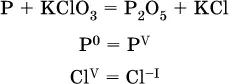
2. Составляют уравнения полуреакцийокисления и восстановления:
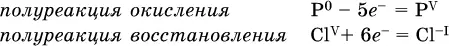
3. Подбирают дополнительные множители(справа за чертой) для уравнений полуреакций так, чтобы число электронов, отданных восстановителем, стало равным числу электронов, принятых окислителем:
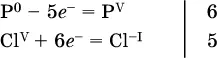
4. Проставляют найденные множителив качестве коэффициентовв схему реакции:
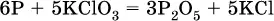
5. Проводят проверку по элементу, который не менял свою степень окисления (чаще всего – кислород):
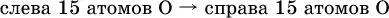
Примеры:
а)
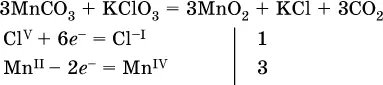
( коэффициентперед СO 2подбирается поэлементно и в последнюю очередь, проверка – по кислороду);
б)
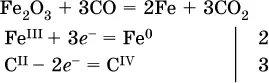
в)
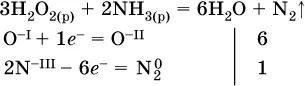
(простые вещества – здесь N 2– пишут в уравнениях полуреакций в молекулярном виде);
г)
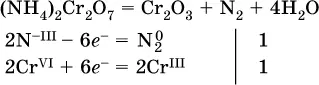
(реакция внутримолекулярного окисления-восстановления, расчет ведут на число атомов в формульной единице реагента – 2N -IIIи 2Cr VI);
д)
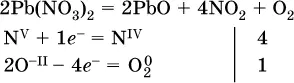
e)
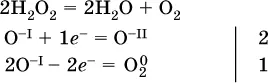
(реакция дисмутации, коэффициенты ставят сначала в правую часть уравнения);
ж)
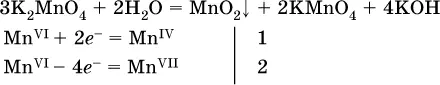
( коэффициентперед К 2MnO 4находят суммированием числа атомов Mn VIв правой части обоих уравнений полуреакций);
з)
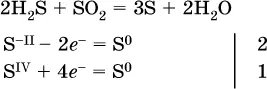
(реакция конмутации, коэффициенты ставят сначала в левую часть уравнения);
и)
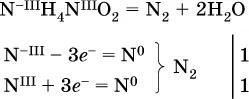
к)
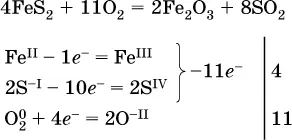
(в FeS 2окисляются атомы Fe IIFe IIIи S -I → S IV, расчет ведут на число этих атомов в формульной единице реагента и суммируют число отданных электронов);
л)
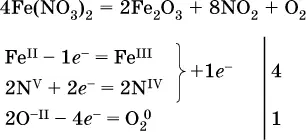
(в реагенте одновременно окисляются атомы первого слева и восстанавливаются атомы второго слева элементов: Fe II → Fe IIIи N V→ N IV, расчет ведут на число этих атомов в формуле реагента и алгебраически суммируют число электронов);
м)
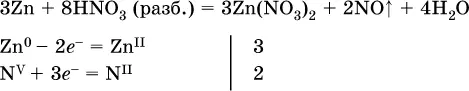
(коэффициент для HNO 3находят суммированием числа атомов N в правой части уравнения);
н)
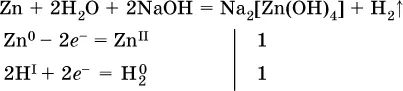
(в раствореZn – восстановитель, H 2O – окислитель; в молекуле воды восстанавливается один атом водорода из двух: Н IОН – Н 0);

(в расплавевосстанавливается атом водорода из гидроксид-иона [ОН I] - → Н 0).
14.3. Ряд напряжений металлов
В ряду напряжений металлов стрелка отвечает уменьшению восстановительной способности металлов и увеличению окислительной способности их катионов в водном растворе (кислотная среда):
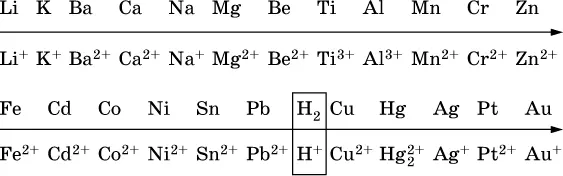
Ряд напряжений позволяет установить:
1) будет ли протекать реакция между металлом и водой; металлы, стоящие в ряду левее Mg, т. е. Li, К, Ва, Са и Na, реагируют с водой по уравнениям:
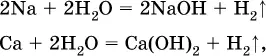
остальные металлы в обычных условиях не реагируют с водой;
2) будет ли протекать реакция с выделением Н 2между металлом и кислотой, которая является окислителем за счет катионов Н +, такими как НCl и H 2SO 4(разб.).
С НCl (разб.) и H 2SO 4(разб.) реагируют почти все металлы, стоящие левееводорода, например:
Читать дальшеИнтервал:
Закладка:










