Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
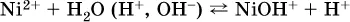
Катион аммония в этом случае образует слабое основание – гидрат аммиака:
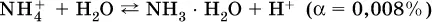
Список гидролизующихся катионов:
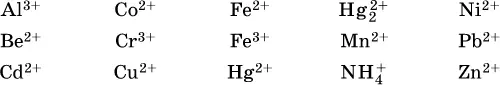
Примеры:
а)
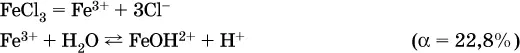
б)
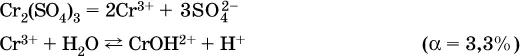
в)
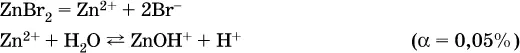
г)
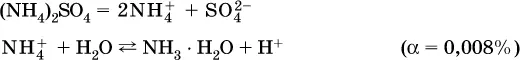
Обратите внимание, что в примерах (а – в) нельзя увеличивать число молекул воды и вместо гидроксокатионов FeOH 2+, CrOH 2+, ZnOH +писать формулы гидроксидов FeO(OH), Cr(OH) 3, Zn(OH) 2. Если бы гидроксиды образовались, то из растворов солей FeCl 3, Cr 2(SO 4) 3и ZnBr 2выпали бы осадки, чего не наблюдается (эти соли образуют прозрачные растворы).
Избыток катионов Н +легко обнаружить индикатором или измерить специальными приборами. Можно также
проделать такой опыт. В концентрированный раствор сильно гидролизующейся по катиону соли, например AlCl 3:
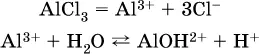
вносится магний или цинк. Последние прореагируют с Н +:
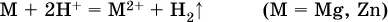
и будет наблюдаться выделение водорода. Этот опыт – дополнительное свидетельство протекания гидролиза катиона Al 3+(ведь в раствор AlCl 3мы не добавляли кислоту!).
1. Сильный электролит – это
1) С 6Н 5ОН
2) СН 3СООН
3) С 2Н 4(ОН) 2
4) К(НСОО)
2. Слабый электролит – это
1) иодоводород
2) фтороводород
3) сульфат аммония
4) гидроксид бария
3. В водном растворе их каждых 100 молекул образуется 100 катионов водорода для кислоты
1) угольной
2) азотистой
3) азотной
4) серной
4—7. В уравнении диссоциации слабой кислоты по всем возможным ступеням
4. Н 3РO 4
5. H 2SeO 3
6. H 4SiO 4
7. HF
сумма коэффициентов равна
1) 3
2) 6
3) 9
4) 12
8—11. Для уравнений диссоциации в растворе двух щелочей набора
8. NaOH, Ва(ОН) 2
9. Sr(OH) 2, Са(ОН) 2
10. КОН, LiOH
11. CsOH, Са(ОН) 2
общая сумма коэффициентов составляет
1) 5
2) 6
3) 7
4) 8
12. В известковой воде содержится набор частиц
1) СаОН+, Са 2+, ОН -
2) Са 2+, ОН -, Н 2O
3) Са 2+, Н 2O, О 2-
4) СаОН +, О 2-, Н+
13—16. При диссоциации одной формульной единицы соли
13. NH 4NO 3
14. К 2Cr 2O 7
15. Al(NO 3) 3
16. Cr 2(SO 4) 3
число образующихся ионов равно
1) 2
2) 3
3) 4
4) 5
17. Наибольшееколичество иона РО 4 -3можно обнаружить в растворе, содержащем 0,1 моль
1) NaH 2PO 4
2) NaHPO 4
3) Н 3РO 4
4) Na 3PO 4
18. Реакция с выпадением осадка – это
1) MgSO 4+ H 2SO 4 →…
2) AgF + HNO 3→…
3) Na 2HPO 4+ NaOH →…
4) Na 2SiO 3+ HCl →…
19. Реакция с выделением газа – это
1) NaOH + СН 3СООН →…
2) FeSO 4+ КОН →…
3) NaHCO 3+ HBr →…
4) Pl(NO 3) 2+ Na 2S →…
20. Краткое ионное уравнение ОН -+ Н += Н 2O отвечает взаимодействию
1) Fe(OH) 2+ НCl →…
2) NaOH + HNO 2→…
3) NaOH + HNO 3→…
4) Ва(ОН) 2+ KHSO 4→…
21. В ионном уравнении реакции
SO 2+ 2OН = SO 3 2-+ Н 2O
ион ОН -может отвечать реагенту
1) Cu(ОН) 2
2) Н 2O
3) LiOH
4) С 6Н 5ОН
22—23. Ионное уравнение
22. ЗСа 2++ 2РO 4 3-= Са 3(РO 4) 2↓
23. Са 2++ НРO 4 2- = СаНРO 4↓
соответствует реакции между
1) Са(ОН) 2и К 3РO 4
2) СаCl 2и NaH 2PO 4
3) Са(ОН) 2и Н 3РО 4
4) СаCl и К 2НРO 4
24—27. В молекулярном уравнении реакции
24. Na 3PO 4+ AgNO 3 →…
25. Na 2S + Cu(NO 3) 2→…
26. Ca(HSO 3) 2[p-p, t] →…
27. K 2SO 3+ 2HBr →… сумма коэффициентов равна
1) 4
2) 5
3) 7
4) 8
28—29. Для реакции полной нейтрализации
28. Fe(OH) 2+ HI →…
29. Ва(ОН) 2+ H 2S →…
сумма коэффициентов в полном ионном уравнении составляет
1) 6
2) 8
3) 10
4) 12
30—33. В кратком ионном уравнении реакции
30. NaF + AlCl 3→…
31. К 2СO 3+ Sr(NO 3) 2→…
32. Mgl 2+ К 3РO 4→…
33. Na 2S + H 2SO 4→…
сумма коэффициентов равна
1) 3
2) 4
3) 5
4) 6
34—36. В водном растворе соли
34. Са(ClO 4) 2
35. AgF
36. Fe 2(SO 4) 3
образуется среда
1) кислотная
2) нейтральная
3) щелочная
4) любая
37. Концентрация гидроксид-иона увеличивается после растворения в воде соли
1) CsNO 3
2) SrCl 2
3) NaCN
4) KHSO 4
38. Нейтральная среда будет в конечном растворе после смешивания растворов исходных солей в наборах
1) ВаCl 2, Fe(NO 3) 3
2) Na 2CO 3, SrS
3) BaS, ZnSO 4
4) MgCl 2, RbNO 3
39. Установите соответствие между солью и ее способностью к гидролизу.

40. Установите соответствие между солью и средой раствора.

41. Установите соответствие между солью и концентрацией катиона водорода после растворения соли в воде.

14. Окислительно-восстановительные реакции. Электролиз
14.1. Окислители и восстановители
Окислительно-восстановительные реакции протекают с одновременным повышением и понижением степеней окисления элементов и сопровождаются передачей электронов:
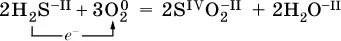
Повышениестепени окисления элемента в ходе реакции, отвечающее потереэлектронов атомами этого элемента, называют окислением : S -II– 6е -= S IV. В данном примере S -IIокисляется до S IV.
Понижениестепени окисления элемента в ходе реакции, отвечающее присоединению электронов атомами этого элемента, называется восстановлением : O 0+ 2е -= О -II. В данном примере О 0восстанавливается до O -II.
Вещество, частицы которого содержат окисляющиеся атомы, выполняет в реакции функцию восстановителя. В данном примере восстановитель – сероводород H 2S.
Вещество, частицы которого содержат восстанавливающиеся атомы, выполняет в реакции функцию окислителя. В данном примере окислитель – молекулярный кислород O 2.
Вещества, являющиеся окислителями или восстановителями во многих реакциях, называются типичными (сильными).
Многие вещества могут проявлять как окислительные, так и восстановительные свойства. К таким веществам принадлежат соединения, содержащие элементы в промежуточной (для них) степени окисления:
Читать дальшеИнтервал:
Закладка:










