Игорь Мерзляков - Квантовая химия в примерах
- Название:Квантовая химия в примерах
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:9785449827685
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Игорь Мерзляков - Квантовая химия в примерах краткое содержание
Квантовая химия в примерах - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Квантовая химия в примерах
Игорь А. Мерзляков
© Игорь А. Мерзляков, 2022
ISBN 978-5-4498-2768-5
Создано в интеллектуальной издательской системе Ridero
1. Введение
Теоретические принципы, положенные в основу данной работы, опираются на аналитическое решение уравнения Шрёдингера, которое было детально исследовано в первой книге серии «Путешествие в квантовую механику». Изучая положения по квантовой химии, читатель сможет разобраться в методике, позволяющей осуществить моделирование кристаллических структур, молекул и химических реакций.
Каждый принцип, связанный с предсказанием химических соединений, в этой работе выделен отдельно, поэтому хотелось бы надеяться на то, что данное обстоятельство поможет читателю быстрее освоить предлагаемый к изучению материал.
Со времён, когда жил и работал М. В. Ломоносов, кристаллография получила своё развитие благодаря учёным, формировавшим знания о ней как об отдельной науке. На сегодняшний день исследователи продолжают изучать симметрии в структурах химических веществ, пытаясь решить в общем виде задачу «компактной упаковки шаров», согласно которой шары (аналогично атомам в кристалле) помещаются в ящик, оставляя наименьшее свободное пространство. Цель подобных исследований состоит в том, чтобы выделить основные типы кристаллических структур. Часто для неоднородных структур остаётся открытым вопрос о диаметрах шаров и размерах упаковки, куда они помещаются, поскольку именно диаметр определяет вид атома, а линейные размеры упаковки дают информацию о будущих свойствах кристаллической решётки. Предлагаемая в книге методика является наиболее универсальной с вычислительной точки зрения по сравнению с другими численными алгоритмами поиска структур, вместе с тем результаты моделирования указывают на идентичность построенных теоретически и полученных на практике химических соединений.
В данной книге мы разберём основные методы, с помощью которых можно прогнозировать строение кристаллических структур и молекул, применяя аналитическое решение уравнения Шрёдингера, а также рассмотрим процессы возникновения и протекания химических реакций. Если химическую структуру возможно построить теоретически, тогда следует констатировать, что соответствующие ей кристалл или молекула будут существовать в природе. Смоделировав то или иное химическое соединение, необходимо определить параметры среды, в которых будет существовать исследуемое вещество на практике. В случае, когда нельзя обосновать теоретически структуру химического соединения, тогда вещество не может быть получено на практике даже в самых критических точках-параметрах среды, в которой оно находится.
Контакты для связи:vk.com/garrydipray, iganmer@gmail.com, iganmer@yandex.ru.
Ссылкана программу «Cepreak»: www.vk.com/cepreak
2. Общие сведения из квантовой механики
Из книги «Путешествие в квантовую механику» [1] известны следующие положения:
а) Полную энергию E электрона, определяемую для заданных квантовых чисел n x, n y, n z в трёхмерной декартовой системе координат, можно выразить в виде тождества:
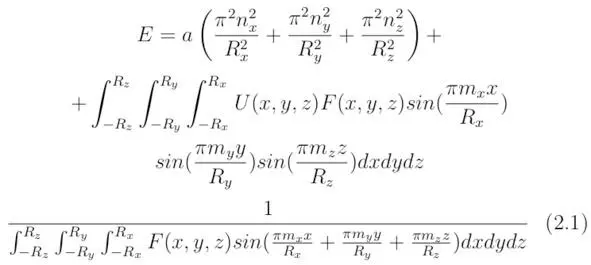
где x,y,z – координаты точек, куда помещается пробный отрицательный заряд (см. раздел 5 [1]), x∈ (-R x, R x), y∈ (-R y, R y), z∈ (-R z, R z), F (x,y,z) – произвольно заданная функция, U (x,y,z) – потенциальная энергия, R x, R y, R z – коэффициенты, определяемые из граничных условий. Величины m x/R x, m y/R y, m z /R z в общем случае будут зависеть от функции распределения внутренней энергии u, расположенной в пространстве потенциальных ям (см. раздел 9 «Принцип суперпозиции. Квантовая запутанность. Квантовый компьютер» [1]). Если квантовая система состоит из одной частицы, тогда коэффициент a можно определить из соотношения a=ħ 2/ (2M), здесь ħ – приведённая постоянная Планка, M – масса электрона, n x, n y, n z – величины, определяющие дискретные значения полной энергии.
б) Получим выражение для вычисления полной энергии квантовой системы, расположенной в произвольно заданном пространстве потенциальных ям. В рассматриваемом примере потребуем, чтобы синусоидальная функция, входящая в состав решения уравнения Шрёдингера, была построена в сферической системе координат (r,θ,φ), тогда:
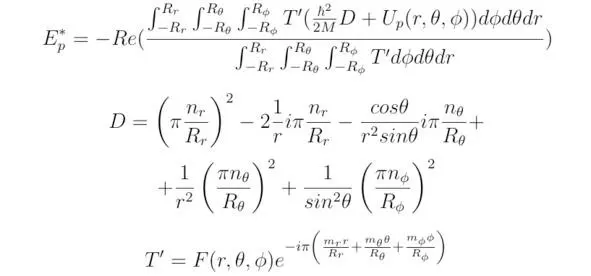
в) Распределение потенциальных ям в пространстве R 3 будет зависеть от значений синусоидальной функции A=sin (πm xx/R x) sin (πm yy/R y) sin (πm zz/R z). В точках, где величина A принимает отрицательные значения A <0, возможно обнаружить электроны, а в точках, где A> 0 – позитроны или ядра атомов.
г) Атомы, существующие в пространстве потенциальных ям, могут иметь любую форму, но для простоты их изображения выберем модель куба. Ядро находится в центре атома. Рассмотрим потенциальные ямы, расположенные на оболочке куба, в которых можно зафиксировать отрицательно заряженные частицы. Количество исследуемых потенциальных ям, определяемое для одного атома вещества, возможно вычислить из выражений (2.1) или (2.2). В процессе заполнения 4s 2орбитали частицы переходят на h+1 уровень. Вместе с тем электроны, расположенные на 4s 2 подуровне, могут спускаться на более низкий уровень (h=3) при условии, что там существуют незаполненные потенциальные ямы.
д) В процессе преобразования величины внутренней энергии коэффициенты m x/R x, m y/R y, m z/R z будут изменяться, что приведёт к трансформации пространства синусоидальной функции A, входящей в решение уравнения Шрёдингера.
е) В разделе 8 [1] были рассмотрены общие положения о строении атома. Ниже приводится справочная информация из книги «Путешествие в квантовую механику» [1].
В первую очередь введём обозначения:
2h-1 – число потенциальных ям, приходящихся на одну сторону куба (атома).
D` – количество потенциальных ям с электронами, которые располагаются на внешней оболочке атома (куба). Размер последней определяется в зависимости от значения квантового уровня h.
Следует отметить, что понятие квантового уровня не соответствует определению энергетического (химического) уровня (схожи лишь их численные значения), поскольку закон заполнения квантовых уровней, в зависимости от их порядковых номеров, учитывает перемещение электронов на более низких или высоких энергетических уровнях. Квантовым уровнем называется каждая новая оболочка атома, построенная как следующий слой из потенциальных ям вокруг куба предыдущего уровня за исключением 1-го, толщиной в один полупериод синусоидальной функции.
Читать дальшеИнтервал:
Закладка:










