Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
- 607 -
Во всех соединениях ртути(I) атомы ртути связаны между собой, образуя двухвалентные группы -Hg 2-(—Hg—Hg—).
Следовательно, ртуть двухвалентна и в этих соединениях, но одна единица валентности каждого атома ртути затрачивается здесь на связь с другим атомом ртути. Эта связь сохраняется и в растворах солей ртути(I), которые содержат ионы ртути. Таким образом, состав солей ртути(I), содержащих одновалентный кислотный остаток R, следует изображать не эмпирической формулой HgR, а формулой Hg 2R 2(например, Hg 2Cl 2).
Одна из особенностей ртути заключается в том, что для нее неизвестны гидроксиды. В тех случаях, когда можно было бы ожидать их образования, получаются безводные оксиды. Так, при действии щелочен на растворы солей ртути(I) получается буроваточерный осадок оксида ртути(I):
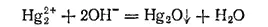
Точно так же из растворов солей ртути(II) щелочи осаждают оксид ртути(II):

Образующийся осадок имеет желтый цвет, но при нагревании переходит в красную модификацию оксида ртути(II).
Нитрат ртути (I) Hg 2(NO 3) 2— одна из немногих растворимых солей ртути(I). Получается при действии разбавленной холодной азотной кислоты на избыток ртути:
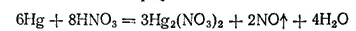
Хлорид ртути (I) Hg 2Cl 2, или каломель, представляет собой белый, нерастворимый в воде порошок. Его приготовляют, нагревая смесь HgCl 2с ртутью:
HgCl 2+ Hg = Hg 2Cl 2
Каломель может быть получена также действием соляной кислоты или хлорида натрия на растворимые соли ртути (I):
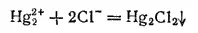
Нитрат ртути(II) Hg 2(NO 3) 2получается при действии избытка горячей азотной кислоты на ртуть. Хорошо растворим в воде. В разбавленных растворах при отсутствии свободной кислоты гидролизуется с образованием белого осадка основной соли HgO·Hg(NO 3) 2. При нагревании с большим количеством воды основная соль также разлагается, в результате чего получается оксид ртути(II).
Хлорид ртути(II), или сулема, HgCl 2может быть получен непосредственным взаимодействием ртути с хлором. Это бесцветное вещество, сравнительно мало растворимое в холодной воде (6,6 г в 100 г воды при 20 °C).
- 608 -
Однако с повышением температуры растворимость сулемы сильно возрастает, достигая при 100°C 58 г в 100 г воды. Из раствора HgCl 2кристаллизуется в виде длинных блестящих призм. Обычно эту соль получают, нагревая сульфат ртути(II) с хлоридом натрия:
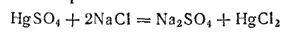
Образующаяся сулема сублимируется; от последнего слова она и получила свое название.
Водный раствор сулемы практически не проводит электрического тока. Таким образом, сулема — одна из немногих солей, которые почти не диссоциируют в водном растворе на ионы. Как указывалось на стр. 147, это объясняется сильной поляризующей способностью иона Hg 2+.
Сулема, как и все растворимые соли ртути, — сильный яд. Она используется для протравливания семян, дубления кожи, получения других соединений ртути, при крашении тканей, как катализатор в органическом синтезе и как дезинфицирующее средство (стр. 352).
Иодид ртути(II) HgI 2выпадает в виде красивого оранжево-красного осадка при действии раствора иодида калия на соли ртути(II):
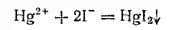
В избытке иодида калия соль легко растворяется, образуя бесцветный раствор комплексной соли K 2[HgI 4]:
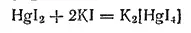
Сульфид ртути(II) HgS встречается в природе (см. выше). Искусственно он может быть получен в виде вещества черного цвета прямым соединением серы со ртутью или действием сероводорода на растворы солей ртути(II).
При пагревашш без доступа воздуха черный сульфид ртути(II) превращается в красное кристаллическое видоизменение - киноварь.
Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Третья группа периодической системы охватывает очень большое число химических элементов, так как в состав ее, кроме элементов главной и побочной подгрупп, входят элементы с порядковыми номерами 58—71 (лантаноиды) и с порядковыми номерами 90—103 (актиноиды). Мы рассмотрим лантаноиды и актиноиды вместе с элементами побочной подгруппы. ГЛАВНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ
Элементы главной подгруппы третьей группы — бор, алюминий, галлий, индий и таллий—характеризуются наличием трех электронов в наружном электронном слое атома.
- 609 -
Второй снаружи электронный слой атома бора содержит два электрона, атома алюминия — восемь, галлия, индия и таллия — по восемнадцать электронов. Важнейшие свойства этих элементов приведены в табл. 35.
Таблица 35. Некоторые свойства бора, алюминия и его аналогов
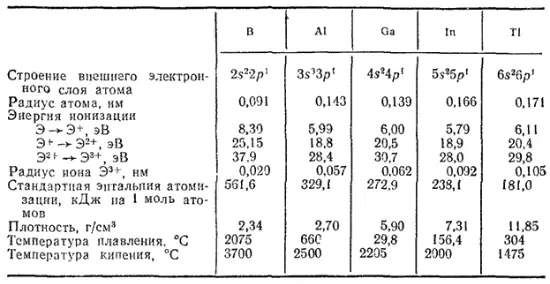
Металлические свойства рассматриваемых элементов выражены слабее, чем у соответствующих элементов главных подгрупп второй и особенно первой группы, а у бора преобладают неметаллические свойства. В соединениях они проявляют степень окисленности +3. Однако с возрастанием атомной массы появляются и более низкие степени окисленности. Для последнего элемента подгруппы — таллия — наиболее устойчивы соединения, в которых его степень окисленности равна +1.
С увеличением порядкового номера металлические свойства рассматриваемых элементов, как и в других главных подгруппах, заметно усиливаются. Так, оксид бора имеет кислотный характер, оксиды алюминия, галлия и индия — амфотерны, а оксид таллия (III) имеет основной характер.
В практическом отношении наиболее важными из элементов третьей группы являются бор и алюминий.
217. Бор (Borum).
Бор сравнительно мало распространен в природе; общее содержание его в земной коре составляет около 10 -3% (масс.).
К главным природным соединениям бора относятся борная кислота H 3BO 3и соли борных кислот, из которых наиболее известна бура Na 2B 4O 7·10H 2O.
Хотя бор расположен в третьей группе периодической системы, он по своим свойствам наиболее сходен не с другими элементами этой группы, а с элементом четвертой группы — кремнием. В этом проявляется «диагональное сходство», уже отмечавшееся при рассмотрении бериллия.
Читать дальшеИнтервал:
Закладка:








