Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
- 610 -
Так, бор, подобно кремнию, образует слабые кислоты, не проявляющие амфотерных свойств, тогда как Al(OH) 3— амфотерное основание. Соединения бора и кремния с водородом, в отличие от твердого гидрида алюминия, — летучие вещества, самопроизвольно воспламеняющиеся на воздухе. Как и кремний, бор образует соединения с металлами, многие из которых отличаются большой твердостью и высокими температурами плавления.
Свободный бор получают восстановлением борного ангидрида B 2O 3магнием. При этом бор выделяется в виде аморфного порошка, загрязненного примесями. Чистый кристаллический бор получают термическим разложением или восстановлением его галогенидов, а также разложением водородных соединений бора. Он имеет черный цвет и среди простых веществ по твердости уступает только алмазу.
Природный бор состоит из двух стабильных изотопов: 10B и 11B. Первый из них сильно поглощает медленные нейтроны. Поэтому бор и его соединения применяются в ядерной технике. Из них изготовляют регулирующие стержни реакторов, а также используют их в качестве материалов, защищающих от нейтронного облучения.
В металлургии бор применяется как добавка к стали и к некоторым цветным сплавам. Присадка очень небольших количеств бора уменьшает размер зерна, что приводит к улучшению механических свойств сплавов. Применяется также поверхностное насыщение стальных изделий бором — борирование, повышающее твердость и стойкость против коррозии.
Вода не действует на бор; концентрированные же серная и азотная кислоты окисляют его в борную кислоту. Например:
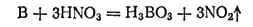
При комнатной температуре бор соединяется только с фтором, на воздухе он не окисляется. Если нагреть аморфный бор до 700°C, то он загорается и горит красноватым пламенем, превращаясь в оксид; при этом выделяется большое количество теплоты:
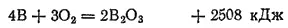
При высокой температуре бор соединяется со многими металлами, образуя бориды, например, борид магния Mg 3B 2. Многие бориды очень тверды и химически устойчивы, причем сохраняют эти свойства при высоких температурах. Для них характерна также тугоплавкость. Например, борид циркония ZrB 2плавится при 3040°C. Благодаря таким свойствам бориды некоторых металлов применяются для изготовления деталей реактивных двигателей и лопаток газовых турбин.
При накаливании смеси бора с углем образуется карбид бора B 4C. Это тугоплавкое вещество (темп, плавл. около 2350°C), обладающее очень высокой твердостью и химической стойкостью.
- 611 -
Карбид бора применяется для обработки твердых сплавов; его механические свойства сохраняются при высоких температурах.
С галогенами бор также реагирует при нагревании и образует вещества общей формулы BГ 3. Как уже было показано на примере BF 3(см. стр. 131), в этих соединениях бор находится в состоянии sp 2-гибридизаиии, образуя с галогенами плоские молекулы с углами между связями Г—В—Г, равными 120°.
Галогениды бора, как и другие соединения бора неполимерного строения, являются электронодефицитными (см. стр. 590). Так, в молекуле фторида бора во внешнем электронном слое атома бора находятся всего шесть электронов:
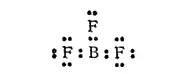
В этом состоянии атом бора может, следовательно, быть акцептором электронной пары. Действительно, BF 3соединяется по донорно-акцепторпому способу с водой, аммиаком и другими веществами; известен также комплексный анион BF 4 -. Во всех подобных соединениях ковалентность и координационное число бора равны четырем, а атом бора находится в состоянии гибридизации sp 3и образует тетраэдрические структуры.
Бороводороды (бораны). При действии соляной кислоты на борид магния Mg 3B 2получается сложная смесь различных бороводородов, анлогичных угле- и кремневодородам. Из этой смеси выделены в чистом виде следующие бороводороды:
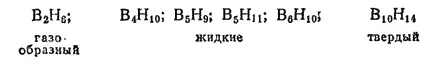
Главным продуктом взаимодействия борида магния с соляной кислотой является тетраборан B 4H 10— летучая жидкость (темп, кип. 18°C) с очень неприятным запахом, пары которой воспламеняются на воздухе. При хранении тетраборан постепенно разлагается с образованием простейшего из полученных бороводородов — диборана B 2H 6. Последний представляет собой газ, конденсирующийся в жидкость при -92.5°C. На воздухе он не загорается, но водой, как и другие бороводороды, тотчас же разлагается с отщеплением водорода и образованием борной кислоты H 3BO 3:
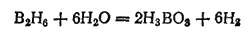
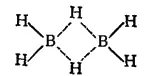
Атомы бора в молекулах бороводородов связаны друг с другом водородными «мостиками», например:
- 612 -
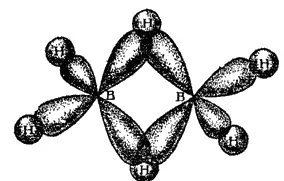
Рис. 164. Перекрывание атомных орбиталей в молекуле диборана.
Пунктиром на этой схеме показаны трехцентровые связи: здесь общая пара электронов занимает молекулярную орбиталь, охватывающую три атома — «мостиковый» атом водорода и оба атома бора. Такая орбиталь образуется вследствие перекрывания ls-орбитали атома водорода с sp 3-гибридными орбиталями двух атомов бора (см. рис. 164). Четыре «концевых» атома водорода связаны с атомами бора обычными двухцентровыми двухэлектронными связями. Таким образом, из двенадцати валентных электронов, имеющихся в атомах, составляющих молекулу диборана. восемь участвуют в образовании двухцентровых связей B-H, а четыре образуют две трехцентровые связи В—Н—В.
Наибольшее практическое значение имеют кислородные соединения бора.
Оксид бора, или борный ангидрид, B 2O 3может быть получен или путем непосредственного соединения бора с кислородом, или прокаливанием борной кислоты. Это бесцветная хрупкая стекловидная масса, плавящаяся при температуре около 300°C. Борный ангидрид очень огнестоек и не восстанавливается углем даже при белом калении. В воде он растворяется с образованием борной кислоты и выделением теплоты:
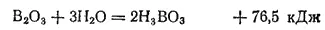
Борная, или ортоборная, кислота H 3BO 3представляет собой белые кристаллы, блестящие чешуйки которых растворяются в горячей воде. Борная кислота может быть получена действием серной кислоты на горячий раствор тетрабората натрия Na 2B 4O 7:
Читать дальшеИнтервал:
Закладка:








