Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Как соли алюминия, так и алюминаты в растворах сильно гидролизованы. Поэтому соли алюминия и слабых кислот в растворах превращаются в основные соли или подвергаются полному гидролизу. Например, при взаимодействии в растворе какой-либо соли алюминия с Na 2CO 3образуется не карбонат алюминия, а его гидроксид и выделяется диоксид углерода:
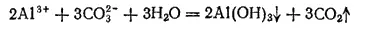
Хлорид алюминия AlCl 3. Безводный хлорид алюминия получается при непосредственном взаимодействии хлора с алюминием. Он широко применяется в качестве катализатора при различных органических синтезах.
- 618 -
В воде AlCl 3растворяется с выделением большого количества теплоты. При выпаривании раствора происходит гидролиз, выделяется хлороводород и получается гидроксид алюминия. Если выпаривание вести в присутствии избытка соляной кислоты, то можно получить кристаллы состава AlCl 3·6H 2O .
Как уже указывалось на стр. 614, химические связи, образуемые атомом алюминия, имеют преимущественно ковалентный характер. Это сказывается на свойствах образуемых им соединений. Так, при нормальном атмосферном давлении безводный хлорид алюминия уже при 180°C сублимируется, а при высоких давлениях плавится при 193°C, причем в расплавленном состоянии не проводит электрический ток. Поэтому расплав AlCl 3нельзя использовать для электролитического получения алюминия.
Сульфат алюминия Al 2(SO 4) 3·18H 2O получается при действии горячей серной кислоты на оксид алюминия или на каолин. Применяется для очистки воды (см. стр. 598), а также при приготовлении некоторых сортов бумаги.
Алюмокалиевые квасцы KAl(SO 4) 2·12H 2O применяются в больших количествах для дубления кож, а также в красильном деле в качестве протравы для хлопчатобумажных тканей. В последнем случае действие квасцов основано на том, что образующийся вследствие их гидролиза гидроксид алюминия отлагается в волокнах ткани в мелкодисперсном состоянии и, адсорбируя краситель, прочно удерживает его на волокне.
219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
Эти элементы принадлежат к числу редких и в сколько-нибудь значительных концентрациях в природе не встречаются. Получают их главным образом из цинковых концентратов после выплавки из них цинка.
В свободном состоянии эти элементы представляют собой серебристо-белые мягкие металлы с низкими температурами плавления. На воздухе они довольно стойки, воду не разлагают, но легко растворяются в кислотах, а галлий и индий — также и в щелочах. Кроме максимальной степени окисленности, равной +3, они могут проявлять и меньшую. В частности, для таллия характерны соединения, где его степень окисленности равна +1.
Оксиды и гидроксиды галлия(III) и индия(III) амфотерны; гидроксид же таллия Tl(OH) 3обладает только основными свойствами.
Соединения таллия(I) сходны, с одной стороны, с соединениями щелочных металлов, с другой, — с соединениями серебра. Так, оксид таллия(I) Tl 2O энергично соединяется с водой, образуя гидроксид, отвечающий формуле TlOH, — сильное, хорошо растворимое в воде основание.
Большинство солей таллия(I) легко растворяется в воде, но соли галогеноводородов, подобно солям серебра, почти нерастворимы и отличаются светочувствительностью; исключение составляет TlF , который как и AgF, хорошо растворим в воде.
- 619 -
Металлическим галлием пользуются для наполнения кварцевых термометров, служащих для измерения высоких температур. Галлий плавится при 29.8°C, а закипает только при 2205°C, так что такие термометры позволяют измерять температуры до 1000°C и выше, что невозможно при употреблении обычных термометров. Добавлением галлия к алюминию получают сплавы, хорошо поддающиеся горячей обработке; сплавы галлия с золотом применяются в ювелирном и зубопротезном деле.
Индий используется вместо серебра для покрытия рефлекторов; рефлекторы, покрытые индием, со временем не тускнеют, и поэтому их коэффициент отражения остается постоянным. Индий применяется также для покрытия вкладышей подшипников и в качестве одного из компонентов сплава для плавких предохранителей.
В качестве присадок к германию и в виде интерметаллических соединений с мышьяком и с сурьмой галлий и индий применяются в полупроводниковой электронике.
Таллий и его соединения имеют небольшое по объему, но разнообразное применение. Галогениды таллия хорошо пропускают инфракрасные лучи. Поэтому они используются в оптических приборах, работающих в инфракрасной области спектра. Карбонат таллия служит для изготовления стекол с высокой преломляющей способностью. Таллий входит в состав вещества электрода селенового выпрямителя, является активатором многих люминофоров. Сульфид таллия используется в фотоэлементах. Металлический таллий — компонент многих свинцовых сплавов: подшипниковых, кислотоупорных, легкоплавких.
Таллий и его соединения весьма токсичны.
ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
Элементы побочной подгруппы третьей группы и семейство, состоящее из четырнадцати f-элементов с порядковыми номерами от 58 до 71, весьма близки друг к другу по своим химическим и физико-химическим свойствам. Эти элементы следуют в периодической системе после лантана и потому называются лантаноидами (или лантанидами). Иногда их вместе с элементами побочной подгруппы третьей группы называют редкоземельными металлами.
Редкоземельные металлы обычно находятся в природе совместно. Они образуют минералы, представляющие собой твердые растворы родственных соединений различных металлов. Например, один из главных источников редкоземельных металлов — минерал монацит — состоит в основном из фосфатов церия, лантана, иттрия и других редкоземельных металлов.
- 620 -
Таким образом, природным сырьем, из которого получают как элементы побочной подгруппы третьей группы, так и лантаноиды, служат одни и те же минералы.
Актиноиды (или актиниды) — это семейство четырнадцати f-элементов с порядковыми номерами от 90 до 103, следующее в периодической системе после актиния.
220. Подгруппа скандия.
В побочную подгруппу третьей группы входят элементы скандий, иттрий, лантан и актиний. Их атомы содержат по два электрона в наружном электронном слое и по 9 электронов в следующем за ним слое; строение этих двух электронных слоев можно выразить формулой (n-1)s 2(n-1)p 6(n-1)d 1ns 2. Каждый из этих элементов открывает собой соответствующую декаду d-элементов. Некоторые их свойства приведены в табл. 36. Степень окисленности элементов подгруппы скандия в большинстве их соединений равна +3.
Таблица 36. Некоторые свойства элементов побочной подгруппы третьей группы
Читать дальшеИнтервал:
Закладка:








