Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
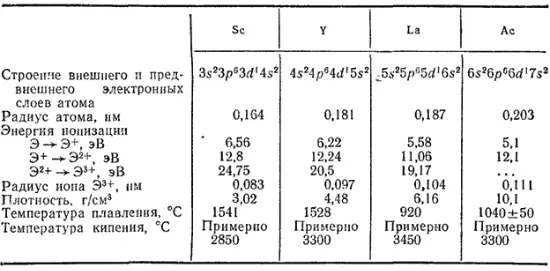
Скандий, иттрий и лантан содержатся в земной коре в количествах порядка 10 -3% (масс.). Актиний содержится в значительно меньшем количестве [порядка 10 -9% (масс.)], так как оба его природные изотопа — 227Ac и 228Ac — радиоактивны.
В свободном состоянии элементы подгруппы скандия представляют собой серебристо-белые металлы с высокими температурами плавления. Металлические свойства выражены у них резче, чем у элементов главной подгруппы. Они растворяются в разбавленных соляной, азотной и серной кислотах, а при нагревании реагируют с большинством неметаллов.
Оксиды элементов этой подгруппы представляют собой тугоплавкие белые вещества. Гидроксиды проявляют основные свойства, усиливающиеся в ряду Sc-Y-La. Так, соли скандия гидролизуются в значительной степени, а соли лантана практически не подвергаются гидролизу: La(OH) 3- сильное основание.
Области применения скандия ограничены. Но в настоящее время намечается пути использования соединений скандия в электронике. В частности, Некоторые ферриты (см. стр. 671), содержащие небольшие количества оксида Скандия, применяются в быстродействующих счетнорешающих устройствах.
- 621 -
Металлический скандий используется в электровакуумной технике как хороший геттер (нераспыляющнйся поглотитель газов).
Оксид иттрия также применяется в производстве ферритов. Ферриты, содержащие иттрий, используются в слуховых приборах, в ячейках памяти счетно-решающих устройств. Изотоп иттрия 90Y применяется в медицине.
Лантан применяется главным образом в смеси с лантаноидами (см. §221).
221. Лантаноиды.
К семейству лантаноидов принадлежат четырнадцать f-элементов, следующих в периодической системе после лантана:
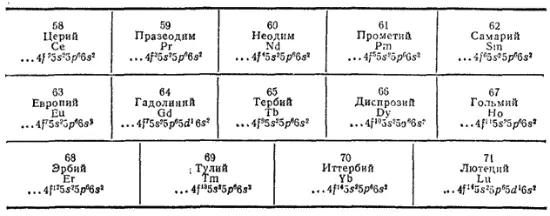
С возрастанием порядкового номера элементов этого семейства происходит заполнение электронами подуровня третьего снаружи электронного слоя ( 4f-подуровня), строение же наружного, а у большинства элементов и следующего за ним слоев остается неизменным. По этой причине все лантаноиды очень близки друг к другу по химическим свойствам.
Электроны заполняют 4f-, а не 5d-подуровень потому, что в этом случае они обладают меньшей энергией. Однако разница в энергиях 4f- и 5d-состояний очень мала. Благодаря этому один из 4f-электронов (а в некоторых случаях, например, у церия, два 4f-электрона) легко возбуждается, переходя на 5d-подуровень, и становится, таким образом, валентным электроном. Поэтому в большинстве своих соединений лантаноиды имеют степень окисленности +3, а не +2. Это обстоятельство объясняет близость свойств лантаноидов к свойствам элементов подгруппы скандия.
В § 34 говорилось, что в пределах одного периода с возрастанием порядкового номера размеры атомов элементов уменьшаются. Подобная закономерность наблюдается не только для элементов главных подгрупп, но, за немногими исключениями, и для элементов побочных подгрупп. Такое же уменьшение радиусов атомов имеет место и в случае лантаноидов (лантаноидное сжатие).
Это явление имеет одно важное следствие. В результате лантаноидного сжатия размеры атомов и иоиов элементов шестого периода, расположенных сразу после лантаноидов (Hf, Ta, W и далее), очень близки к размерам атомов и ионов соответствующих элементов пятого периода (Zr, Nb, Mo и т. д.); в то же время для элементов четвертого и пятого периодов эти характеристики заметно различаются (табл. 37).
- 622 -
Таблица 37. Радиусы атомов (в нм) некоторых элементов побочных подгрупп
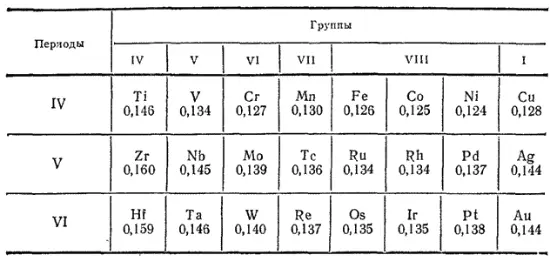
Благодаря тому, что атомы и ионы аналогичных элементов побочных подгрупп пятого и шестого периодов имеют не только сходное электронное строение, но и практически совпадающие размеры, в их химических свойствах наблюдается гораздо более близкое сходство, чем в случае элементов четвертого и пятого периодов. Так, цирконий по своим свойствам значительно ближе к гафнию, чем к титану, ниобий сходен с танталом в большей степени, чем с ванадием и т. д.
В свободном состоянии лантаноиды представляют собою типичные металлы, сходные с лантаном или с иттрием. Их оксиды нерастворимы в воде, но легко присоединяют воду с образонием гидроксидов. Последние лишь незначительно растворяются в воде и имеют основной характер. Соли лантаноидов по своей растворимости подобны соответствующим солям лантана или иттрия.
Прометий не имеет стабильных изотопов и в природе не обнаружен.
Вследствие очень большой близости химических свойств соединений лантаноидов, выделение их в чистом виде из природных смесей очень затруднено. Лишь в последние 20—30 лет разработаны эффективные методы разделения лантаноидов. В настоящее время все они получены в виде чистых металлов.
Многие лантаноиды и их соединения нашли применение в различных областях науки и техники. Они применяются в производстве стали, чугуна и сплавов цветных металлов. При этом используется главным образом мишметалл — сплав лантаноидов с преобладающим содержанием церия и лантана. Добавка малых количеств редкоземельных металлов повышает качество нержавеющих, быстрорежущих, жаропрочных сталей и чугуна. При введении 0,35% мишметалла в нихром срок его службы при 1000°C возрастает в 10 раз. Добавка лантаноидов к сплавам алюминия и магния увеличивает их прочность при высоких температурах.
- 623 -
Один из крупных потребителей редкоземельных металлов — стекольная промышленность. Стекло, содержащее церий, не тускнеет под действием радиоактивных излучений и применяется в атомной технике. Оксиды лантана и неодима входят в состав многих оптических стекол. Небольшие добавки оксидов лантаноидов используются для обесцвечивания стекол и для придания им окраски. Так, Nd 2O 3придает стеклу ярко-красный цвет, а Pr 2O 3- зеленый. Оксиды лантаноидов используются также для окраски фарфора, глазури, эмали.
Радиоактивный изотоп тулия 170Tm применяется для изготовления портативных генераторов рентгеновских лучей медицинского назначения
222. Актиноиды.
К семейству актиноидов принадлежат четырнадцать f-элементов, следующих в периодической системе после актиния:
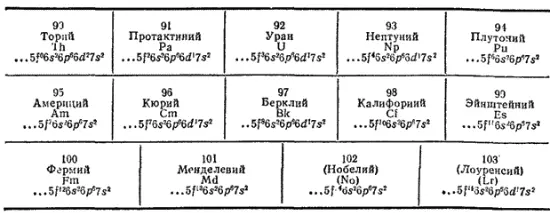
Как и в случае лантаноидов, у элементов семейства актиноидов происходит заполнение третьего снаружи электронного слоя (подуровня 5f); строение же наружного и, как правило, предшествующего электронных слоев остается неизменным. Это служит причиной близости химических свойств актиноидов. Однако различие в энергетическом состоянии электронов, занимающих 5f- и 6d-подуровни в атомах актиноидов, еще меньше, чем соответствующая разность энергий в атомах лантаноидов. Поэтому у первых членов семейства актиноидов 5f-электроны легко переходят на подуровень 6d и могут принимать участие в образовании химических связей. В результате от тория до урана наиболее характерная степень окисленности элементов возрастает от +4 до +6 . При дальнейшем продвижении по ряду актиноидов происходит энергетическая стабилизация 5f-состояния, а возбуждение электронов на 6й-подуровень требует большей затраты энергии. Вследствие этого от урана до кюрия наиболее характерная степень окисленности элементов понижается от +6 до +3 (хотя для нептуния и плутония получены соединения со степенью окисленности этих элементов +6 и +7).
Читать дальшеИнтервал:
Закладка:








