Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
У атома стронция (Z=38) подуровень 5s занят двумя электронами, после чего происходит заполнение 4d-подуровня, так что следующие десять элементов — от иттрия (Z=39) до кадмия (Z=48) — принадлежат к переходным d-элементам. Затем от индия до благородного газа ксенона расположены шесть p-элементов, которыми и завершается пятый период. Таким образом, четвертый и пятый периоды по своей структуре оказываются вполне аналогичными.
* Существуют d-элементы (например, хром, молибден, элементы подгруппы меди), у атомов которых во внешнем электронном слое имеется только один s-электрон. Причины этих отклонений от «нормального» порядка заполнения электронных энергетических подуровней рассмотрены в конце параграфа.
- 92 -
Шестой период, как и предыдущие, начинается с двух s-элементов (цезий и барий), которыми завершается заполнение орбиталей с суммой (n+l), равной 6. Теперь в соответствии с правилами Клечковского, должен заполняться подуровень 4f (n=4, l=3) с суммой (n+l), равной 7б и с наименьшим возможным при этом значении главного квантового числа. На самом же деле у лантана (Z=57), расположенного непосредственно после бария, появляется не 4f, а 5d-электрон, так что его электронная структура соответствует формуле 1s 22s 22p 63s 23p 63d 104s 24p 64d 105s 25p 65d 16s 2. Однако уже у следующего за лантаном элемента церия (Z=58) действительно начинается застройка подуровня 4f на который переходит и единственный 5d-электрон, имевшийся в атоме лантана; в соответствии с этим электронная структура атома церия выражается формулой 1s 22s 22p 63s 23p 63d 104s 24p 64d 104f 25s 25p 66s 2. Таким образом, отступление от второго правила Клечковского, имеющее место у лантана, носит временный характер: начиная с церия, происходит последовательно заполнение всех орбиталей 4f-подуровня. Расположенные в этой части шестого периода четырнадцать лантаноидов относятся к f-элементам и близки по свойствам к лантану. Характерной особенностью построения электронных оболочек их атомов является то, что при переходе к последующему f-элементу новый электрон занимает место не во внешнем (n=6) и не в предшествующем (n=5), а в еще более глубоко расположенном, третьем снаружи электронном слое (n=4).
Благодаря отсутствию у атомов лантаноидов существенных различий в структуре внешнего и предвнешнего электронных слоев, все лантаноиды проявляют большое сходство в химических свойствах.
Заполнение 5d-подуровня, начатое у лантана, возобновляется у гафния (Z=72) и заканчивается у ртути (Z=80). После этого, как и в предыдущих периодах, располагаются шесть p-элементов. Здесь происходит построение 6p-подуровня: оно начинается у таллия (Z=81) и заканчивается у благородного газа радона (Z=86), которым и завершается шестой период.
Седьмой, пока незавершенный период системы элементов построен аналогично шестому. После двух s-элементов (франций и радий) и одного d-элемента (актиний) здесь расположено 14 f-элементов, свойства которых проявляют известную близость к свойствам актиния. Эти элементы, начиная с тория (Z=90) и кончая элементом 103, обычно объединяют под общим названием актиноидов. Среди них — менделевий (Z=101), искусственно полученный американскими физиками в 1955 г. и названный в честь Д. И. Менделеева. Непосредственно за актиноидами расположен курчатовий (Z=104) и элемент 105. Оба эти элемента искусственно получены группой ученых во главе с академиком Г. Н. Флеровым; они принадлежат к d-элементам и завершают известную пока часть периодической системы элементов.
Распределение электронов по энергетическим уровням (слоям) в атомах всех известных химических элементов приведена в периодической системе элементов, помещенной в начале книги.
- 93 -
Последовательность заполнения электронами энергетических уровней и подуровней в атомах схематически представлена на рис. 23, графически выражающем правила Клечковского. Заполнение происходит от меньших значений суммы (n+l) к большим в порядке, указанном стрелками. Нетрудно заметить, что эта последовательность совпадает с последовательностью заполнения атомных орбиталей, показанной на рис. 22.
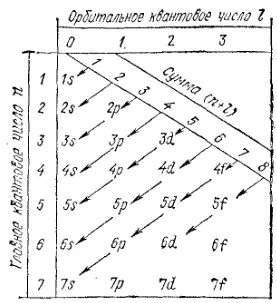
Рис. 23. Схема последовательности заполнения электронных энергетических подуровней в атоме.
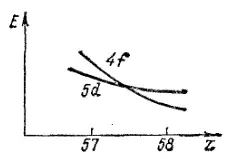
Рис. 24. Зависимость энергии 4f- и 5d-электронов от заряда ядра Z.
Следует иметь в виду, что последняя схема (как и сами правила Клечковского) не отражает частных особенностей электронной структуры атомов некоторых элементов. Например, при переходе от атома никеля (Z=28) к атому меди (Z=29) число 3d-электронов увеличивается не на один, а сразу на два за счет «проскока» одного из 4s-электронов на подуровень 3d. Таким образом, электронное строение атома меди выражается формулой 1s 22s 22p 63s 23p 63d 104s 1. Аналогичный «проскок» электрона с внешнего s- на d-подуровень предыдущего слоя происходит и в атомах аналогов меди — серебра и золота. Это явление связано с повышенной энергетической устойчивостью электронных структур, отвечающих полностью занятым энергетическим подуровням (см. § 34). Переход электрона в атоме меди с подуровня 4s на подуровень 3d (и аналогичные переходы в атомах серебра и золота) приводит к образованию целиком заполненного d-подуровня и поэтому оказывается энергетически выгодным.
Как будет показано в § 34, повышенной энергетической устойчивостью обладают и электронные конфигурации с ровно наполовину заполненным подуровнем (например, структуры, содержащие три р-электрона во внешнем слое, пять d-электронов в предвнешнем слое или сеть f-электронов в еще более глубоко расположенном слое). Этим объясняется «проскок» одного 4s-электрона в атоме хрома (Z=24) на 3d-подуроень, в результате которого атом хрома приобретает устойчивую электронную структуру (1s 22s 22p 63s 23p 63d 54s 1) с ровно наполовину заполненным 3d-подуровнем; аналогичный период 5s-электрона на 4d-подуровень происходит и в атоме молибдена (Z=42).
Упомянутые выше нарушения «нормального» порядка заполнения энергетических состояний в атомах лантана (появление 5d-, а не 4f-электрона) и церия (появление сразу двух 4f-электронов) и аналогичные особенности в построении электронных структур атомов элементов седьмого периода объясняются следующим. При увеличении заряда ядра электростатическое притяжение к ядру электрона, находящегося на данном энергетическом подуровне, становится более сильным, и энергия электрона уменьшается.
- 94 -
При этом энергия электронов, находящихся на различных подуровнях, изменяется неодинаково, поскольку по отношению к этим электронам заряд ядра экранируется в разной степени. В частности, энергия 4f-электронов уменьшается с ростом заряда ядра более резко, чем энергия 5d-электронов (см. рис. 24). Поэтому оказывается, что у лантана (Z=57) энергия 5d-электронов ниже, а у церия (Z=58) выше, чем энергия 4f-электронов. В соответствии с этим, электрон, находившийся у лантана на подуровне 5d, переходит у церия на подуровень 4f.
Читать дальшеИнтервал:
Закладка:








