Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
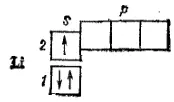
- 86 -
Число и взаимное расположение квантовых ячеек на последней схеме показывает, что 1) электроны в атоме лития расположены на двух энергетических уровнях, причем первый из них состоит из одного подуровня (1s) и целиком заполнен; 2) второй — внешний -энергетический уровень соответствует более высокой энергии и состоит из двух подуровней (2s и 2p); 3) 2s-подуровень включает одну орбиталь, на которой в атоме лития находится один электрон; 4) 2p-подуровень включает три энергетически равноценные орбитали, которым соответствует более высокая энергия, чем энергия, отвечающая 2s-орбитали; в невозбужденном атоме лития 2p-орбитали остаются незанятыми.
В дальнейшем на электронных схемах мы для упрощения будем указывать только не полностью занятые энергетические уровни. В соответствии с этим, строение электронной оболочки атома следующего элемента второго периода — бериллия (Z=4) — выражается схемой
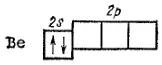
или формулой 1s 22s 2. Таким образом, как и в первом периоде, построение второго периода начинается с элементов, у которых впервые появляются s-электроны нового электронного слоя. Вследствие сходства в структуре внешнего электронного слоя, такие элементы проявляют много общего и в своих химических свойствах. Поэтому их принято относить к общему семейству s-элементов.
Электронная структура атома следующего за бериллием элемента — бора (Z=5) изобразится схемой
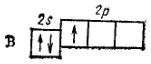
и может быть выражена формулой 1s 22s 22p 1.
При увеличении заряда ядра еще на единицу, т.е. при переходе к углероду (Z=6), число электронов на 2p-подуровне возрастает до 2: электронное строение атома углерода выражается формулой 1s 22s 22p 2. Однако этой формуле могла бы соответствовать любая из трех схем:
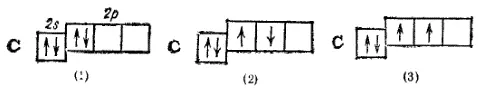
Согласно схеме (1), оба 2p-электрона в атоме углерода занимают одну и ту же орбиталь, т.е. их магнитные квантовые числа одинаковы, а направления спинов противоположны; схема (2) означает, что 2p-электроны занимают разные орбитали (т.е. обладают различными значениями m) и имеют противоположно направленные спины; наконец, из схемы (3) следует, что двум 2p-электронам соответствуют разные орбитали, а спины этих электронов направлены одинаково.
- 87 -
Анализ атомного спектра углерода показывает, что для невозбужденного атома углерода правильна именно последняя схема, соответствующая наибольшему возможному значения суммарного спина атома ( так называется сумма спинов все входящих в состав атома электронов; для схем атома углерода (1) и (2) эта сумма равна нулю, а для схемы (3) равна единице).
Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально .
Отметим, что правило Хунда не запрещает другого распределения электронов в пределах подуровня. Оно лишь утверждает, что устойчивому, т.е. невозбужденному состоянию, в котором атом обладает наименьшей возможной энергией; при любом другом распределении электронов энергия атома будет иметь большее значение, так что он будет находиться в возбужденном , неустойчивом состоянии.
Пользуясь правилом Хунда, нетрудно составить схему электронного строения для атома следующего за углеродом элемента — азота (Z=7):
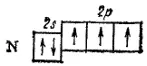
Этой схеме соответствует формула 1s 22s 22p 3.
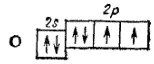
Теперь, когда каждая из 2р-орибалей занята одним электроном, начинается попарное размещение электронов на 2р-орбиталеях. Атому кислорода (Z=8) соответствует формула электронного строения 1s 22s 22p 4и следующая схема:
У атома фтора (Z=9) появляется еще один 2р-электрон. Его электронная структура выражается, следовательно формулой 1s 22s 22p 5и схемой:
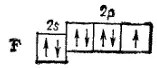
- 88 -
Наконец, у атома неона (Z=10) заканчивается заполнение 2р-подуровня, а тем самым заполнение второго энергетического уровня (L-слоя) и построение второго периода системы элементов.
Таким образом, начиная с бора (Z=5) и заканчивая неоном (Z=10), происходит заполнение р-подуровня внешнего электронного слоя;; элементы этой части второго периода относятся, следовательно, к семейству р-элементов.
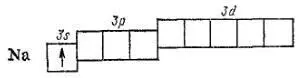
Атому натрия (Z=11) и магния (Z=12) подобно первым элемента второго периода — литию и бериллию — содержат во внешнем слое соответственно один или два s-электрона. Их строению отвечают электронные формулы 1s 22s 22p 63s 1(натрий) и 1s 22s 22p 63s 2(магний) и следующие схемы:
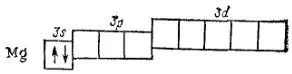
Далее, начиная с алюминия (Z=13), происходит заполнение подуровня 3р. Оно заканчивается у благородного газа аргона (Z=18), электронное строение которого выражается схемой
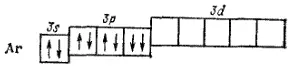
и формулой 1s 22s 22p 63s 23p 6.
Таким образом, третий период, подобно второму,начинается с двух s-элементов, за которыми следует шесть р-элементов. Структура внешнего электронного слоя соответствующих элементов второго и третьего периодов оказывается, следовательно, аналогичной. Так, у атомов лития и натрия во внешнем электронном слое находится по одному s-электрону, у атомов азота и фосфора — по два s- и по три р-электрона и т.д. Иначе говоря, с увеличением заряда ядра электронная структура внешних электронных слоев атомов периодически повторяется. Ниже мы увидим, что это справедливо и для элементов последующих периодов. Отсюда следует, что расположение элементов в периодической системе соответствует электронному строению их атомов . Но электронное строение атомов определяется зарядом их ядер и, в свою очередь, определяет свойства элементов и их соединений. В этом и состоит сущность периодической зависимости свойств элементов от заряда ядра их атомов, выражаемой периодическим законом.
Читать дальшеИнтервал:
Закладка:








