Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
В результате этого уменьшается скорость прямой реакции. Одновременно появляются продукты реакции, и их концентрация возрастает. Вследствие этого начинает идти обратная реакция, причем ее скорость постепенно увеличивается. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает химическое равновесие. Так, в последнем примере устанавливается равновесие между азотом, водородом и аммиаком.
Химическое равновесие называют динамическим равновесием. Этим подчеркивается, что при равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не заметно.
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Рассмотрим ее на примере реакции синтеза иодо-водорода:
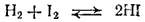
Согласно закону действия масс, скорости прямой (v 1) и обратной (v 2) реакций выражаются уравнениями*:

При равновесии скорости прямой и обратной реакций равны друг другу, откуда
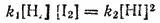
или
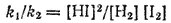
Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции (К):
k 1/k 2= K
Отсюда окончательно
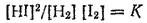
В левой части этого уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии— равновесные концентрации. Правая же часть уравнения представляет собой постоянную (при постоянной температуре) величину.
* Система рассматривается при повышенных температурах, когда иод находится в состоянии пара.
- 178 -
Можно показать, что в общем случае обратимой реакции

константа равновесия выразится уравнением:
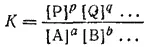
Здесь большие буквы обозначают формулы веществ, а маленькие — коэффициенты в уравнении реакции.
Таким образом, при постоянной температуре константа равновесия обратимой реакции представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии.
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собою. Изменение концентрации любого из этих веществ влечет за собою изменения концентраций всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Численное значение константы равновесия в первом приближении характеризует выход* данной реакции. Например, при K ≫ 1 выход реакции велик, потому что при этом
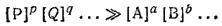
т. е. при равновесии концентрации продуктов реакции много больше концентраций исходных веществ, а это и означает, что выход реакции велик. При K ≪ 1 (по аналогичной причине) выход реакции мал.
В случае гетерогенных реакций в выражение константы равновесия, так же как и в выражение закона действия масс (см. § 58), входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Например, для реакции
CO 2+ C = 2CO
константа равновесия имеет вид:
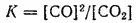
Величина константы равновесия зависит от природы реагирующих веществ и от температуры. От присутствия катализаторов она не зависит. Как уже сказано, константа равновесия равна отношению констант скорости прямой и обратной реакции. Поскольку катализатор изменяет энергию активации и прямой, и обратной реакций на одну и ту же величину (см. § 60), то на отношение констант их скорости он не оказывает влияния.
Поэтому катализатор не влияет на величину константы равновесия и, следовательно, не может ни увеличить, ни снизить выход реакции. Он может лишь ускорить или замедлить наступление равновесия.
64. Смещение химического равновесия. Принцип Ле Шателье.
Если система находится в состоянии равновесия, то она будет пребывать в нем до тех пор, пока внешние условия сохраняются постоянными. Если же условия изменятся, то система выйдет из равновесия — скорости прямого и обратного процессов изменятся неодинаково — будет протекать реакция. Наибольшее значение имеют случаи нарушения равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в равновесии, давления или температуры.
Рассмотрим каждый из этих случаев.
Нарушение равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в реакции.
Пусть водород, иодоводород и пары иода находятся в равновесии друг с другом при определенных температуре и давлении. Введем в систему дополнительно некоторое количество водорода. Согласно закону действия масс, увеличение концентрации водорода повлечет за собой увеличение скорости прямой реакции — реакции синтеза HI, тогда как скорость обратной реакции не изменится. В прямом направлении реакция будет теперь протекать быстрее, чем в обратном. В результате этого концентрации водорода и паров иода будут уменьшаться, что повлечет за собою замедление прямой реакции, а концентрация HI будет возрастать, что вызовет ускорение обратной реакции. Через некоторое время скорости прямой и обратной реакций вновь сравняются— установится новое равновесие. Но при этом концентрация HI будет теперь выше, чем она была до добавления H 2, а концентрация I 2— ниже.
Процесс изменения концентраций, вызванный нарушением равновесия, называется смещением или сдвигом равновесия. Если при этом происходит увеличение концентраций веществ, стоящих в правой части уравнения (и, конечно, одновременно уменьшение концентраций веществ, стоящих слева), то говорят, что равновесие смещается вправо, т. е. в направлении течения прямой реакции; при обратном изменении концентраций говорят о смещении равновесия влево — в направлении обратной реакции. В рассмотренном примере равновесие сместилось вправо. При этом то вещество (H 2), увеличение концентрации которого вызвало нарушение равновесия, вступило в реакцию — его концентрация понизилась.
Таким образом, при увеличении концентрации какого-либо из веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества; при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
Читать дальшеИнтервал:
Закладка:








