Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Однако попытка объяснить направленность химических процессов только стремлением к минимуму внутренней энергии приводит к противоречиям с фактами.
* В отсутствие катализатора скорость этой реакции при обычных условиях крайне мала. однако при наличии катализаора (например, платинированного асбеста) процесс образования воды протекает с большой скоростью.
- 183 -
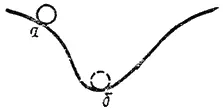
Рис. 69. Шарик самопроизвольно скатывается из положения а в положение б.
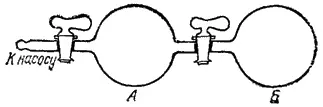
Рис. 70. Сосуд, состоящий из двух частей: в части А находится разреженный газ, в часта Б — вакуум.
Так, уже при обычных температурах самопроизвольно протекают эндотермические процессы растворения многих солей и некоторые эндотермические химические реакции. С повышением температуры все большее число реакций начинает самопроизвольно протекать в направлении эндотермического процесса; примерами таких реакций могут служить упомянутое выше разложение воды или протекающий при высоких температурах синтез оксида азота (II):
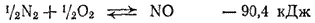
Более того, принцип стремления к минимуму внутренней энергии требует, чтобы все экзотермические реакции доходили до конца, т. е. исключает возможность обратимых реакций; однако такие реакции реально существуют.
Вспомним теперь, что среди механических систем имеются такие, поведение которых тоже нельзя описать только направленностью процессов к достижению минимума потенциальной энергии. Это системы, состоящие из очень большого числа частиц. Например, молекулы, входящие в состав воздуха, распределяются вокруг Земли в виде атмосферы многокилометровой толщины, но не падают на Землю, хотя минимуму потенциальной энергии каждой молекулы соответствует наиболее низкое ее положение.
Из громадного числа частиц состоят и химические системы. Поэтому неудивительно, что и здесь тенденция к достижению минимума внутренней энергии не является единственным фактором, определяющим их поведение.
Для того чтобы составить представление о втором факторе, влияющем на направление реакций, рассмотрим какой-либо самопроизвольно протекающий процесс, не сопровождающийся тепловым эффектом. Примером такого процесса может служить расширение разреженного газа.
Пусть в части А сосуда, разделенного на две части (рис. 70), находится разреженный газ. В таком газе среднее расстояние между молекулами велико; при этом условии внутренняя энергия газа не зависит от степени его разрежения. Вторая половина сосуда (Б) газа не содержит. Если открыть кран, соединяющий обе части сосуда, то газ самопроизвольно распространится по всему сосуду.
Внутренняя энергия газа при этом не изменится; тем не менее, самопроизвольно произойдет именно процесс расширения газа, а обратный процесс — самопроизвольное сжатие газа — не происходит.
Причины такой направленности процесса можно понять, если сначала рассмотреть систему, содержащую небольшое число молекул. Пусть в сосуде находятся всего две молекулы, которые обозначим 1 и 2. Равномерное распределение газа между обеими частями сосуда, соответствующее определенному макросостоянию газа, может осуществиться двумя микросостояниями;
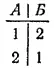
Макросостояние, при котором весь газ сосредоточен в одной из частей сосуда (например, в части А), осуществляется единственным микросостоянием:
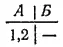
Очевидно, что то или иное макросостояние системы тем более вероятно, чем большим числом микросостояний оно может осуществиться. В рассматриваемом случае (две молекулы) равномерное распределение газа по сосуду вдвое вероятнее, чем переход всего газа в часть сосуда А.
Пусть теперь в сосуде находится четыре молекулы, которые мы вновь пронумеруем. Переходу всего газа в часть сосуда А по-прежнему соответствует единственное микросостояние:
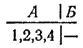
Между тем, равномерное распределение газа между обеими частями сосуда может теперь осуществляться шестью различными микросостояниями:

Теперь, следовательно, вероятность равномерного распределения молекул газа по всему объему сосуда оказывается заметно более высокой, чем вероятность их перехода в одну из его частей. Естественно, что равномерное распределение газа будет наблюдаться гораздо чаще, чем полное его сосредоточение в части сосуда.
Если в сосуде находится шесть молекул, то переходу их в одну из частей сосуда (т. е. самопроизвольному сжатию газа до половины занимаемого им первоначального объема), как и раньше, соответствует только одно микросостояние. Но равномерному распределению газа между обеими частями сосуда отвечает уже 20 возможных комбинаций молекул, т. е. 20 различных микросостояний:
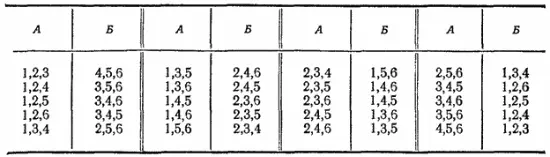
Теперь явление самопроизвольного сжатия газа, т. е. сосредоточения всех его молекул в одной из частей сосуда, будет наблюдаться еще реже; равномерное же распределение газа по всему сосуду становится еще более вероятным.
Таким образом, с ростом числа молекул вероятность беспорядочного, равномерного распределения газа в сосуде очень быстро возрастает, а самопроизвольное сжатие газа становится все менее вероятным процессом. Если мы вспомним теперь, что макроскопические количества газа содержат огромное число молекул, то станет ясно, что в реальном опыте самопроизвольное сжатие газа представляет собой процесс практически невозможный, и что самопроизвольно будет протекать обратный процесс расширения газа, приводящий к равномерному, беспорядочному распределению его молекул по всему объему сосуда.
Рассмотренное нами явление расширения газа представляет собой пример проявления принципа направленности процессов к наиболее вероятному состоянию, т. е. к состоянию, которому соответствует максимальная беспорядочность распределения частиц. Направление самопроизвольного протекания химических реакций и определяется совокупным действием двух факторов: тенденцией к переходу системы в состояние с наименьшей внутренней энергией и тенденцией к достижению наиболее вероятного состояния.
Читать дальшеИнтервал:
Закладка:








