Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Таблица 7. Стандартная энтальпия образования и стандартная энергия Гиббса образования некоторых веществ при 298 К (25°С)
Сокращенные обозначения агрегатного состояния веществ: г — газообразное, ж — жидкое, к — кристаллическое.
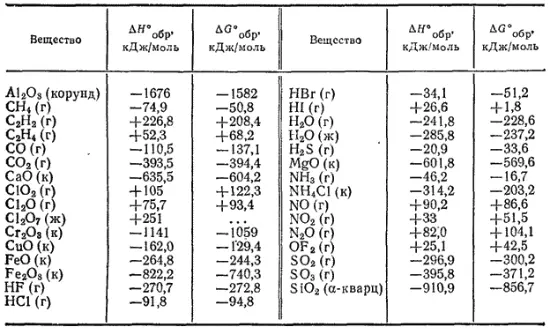
В табл. 7 приведены значения стандартных энтальпий и энергий Гиббса образования некоторых веществ при 25°С (298 К). Более полные данные этого рода можно найти в справочниках, например, в «Кратком справочнике физико-химических величин» под редакцией А. А. Равделя и А. М. Пономаревой (издание восьмое, 1983 г.).
Пример 1. Вычислить ΔH° 298, тепловой эффект при 298 К и постоянном давлении и ΔG° 298реакции:
Fe 2O 3+ 2Al = Al 2O 3+2Fe
Вычисление ΔH° 298и теплового эффекта реакции. Находим в табл. 7 ΔH° обрFe 2O 3(-822.2 кДж/моль) и Al 2O 3(-1676 кДж/моль) при 298 К и производим алгебраическое суммирование:
ΔG° 298= -1676 -(-822,2) = -853,8 кДж
Поскольку изменение энтальпии реакции равно по величине, но обратно по знаку ее тепловому эффекту при постоянных температуре и давлении (см. стр. 189), то термохимическое уравнение ракции запишется следующим образом:
Fe 2O 3+ 2Al = Al 2O 3+2Fe + 853,8 кДж
При низких температурах знак изменения энтальпии реакции может служить для ориентировочного определения возможного направления реакции. Полученное для рассматриваемой реакции отрицательное значение ΔH° указывает на возможность ее самопроизвольного протекания при достаточно низких температурах; при этом большое абсолютное значение ΔH° позволяет с достаточной вероятностью предполагать, что в условиях, не очень сильно отличающихся от стандартных, эта реакция тоже может протекать в прямом направлении.
Вычисление ΔG° 298реакции. Находим в табл. 7 ΔG° обрFe 2O 3(-740.3 кДж/моль) и Al 2O 3(-1582 кДж/моль) при 298 К и производим суммирование:
ΔG° 298= -1582 - (-740,3)= -831,7 кДж
Полученное отрицательное значение ΔG° 298подтверждает вывод, сделанный на основе оценки ΔH° 298реакции. Близость найденных значений ΔH° 298и ΔG° 298связана, в частности, с тем, что при протекании рассматриваемой реакции не меняется число молекул газов (в нашем примере ни исходные вещества, ни продукты реакции не являются газами). При изменении же числа молекул Газов может существенно изменяться энтропия системы (переход в газообразное состояние сопровождается сильным возрастанием молекулярного беспорядка!), вследствие чего значения ΔH° и ΔG° могут не только заметно различаться по величине, но даже иметь разные знаки (см. пример 2). Поэтому в подобных случаях знак ΔH° не может служить определенным критерием направления самопроизвольного протекания реакции.
Большое абсолютное значение ΔG° 298, найденное для рассматриваемой реакции, позволяет с достаточной вероятностью говорить о возможности протекания этой реакции в прямом направлении не только при стандартной температуре (25°C), но и при других температурах. В случае малых абсолютных значений ΔG° 298, а также для реакций, протекающих с изменением числа молекул уазов, такого заключения делать нельзя; в подобных случаях нужно знать зависимость ΔG° от температуры.
Пример 2. Вычислить ΔH° 298, тепловой эффект при 298 К и постоянном давлении ΔG° 298реакции:
CuO + C = Cu + CO
Вычисление ΔH° 298реакции. Находим в табл. 7 ΔH° обрCuO(-162.0 кДж/моль) и СО (-110.5 кДж/моль) при 298 К и производим суммирование:
ΔH° 298= -110,5 - (- 162,0) = 51,5 кДж
Таким образом
CuO + C = Cu + CO - 51,5 кДж
Полученное значение ΔH° 298положительно, но мало по абсолютной величине. Поэтому оно не может служить критерием направления протекания реакции даже при невысоких температурах, тем более, что в рассматриваемом случае в результате реакции изменяется число молекул газов.
Вычисление ΔG° 298реакции. Находим в табл. 7 ΔG° обрCuO(-129.4 кДж/моль) и СО (-137.1 кДж/моль) при 298 К и производим суммирование:
ΔG° 298= - 137,1 - (-129,4) = - 7,7 кДж
Полученное значение ΔG° 298тоже мало по абсолютной величине, но отрицательно. Оно указывает на возможность протекания реакции в прямом направлении при стандартных условиях, по не дает оснований для выводов о ее направлении при условиях, отличающихся от стандартных.
В данном примере разные знаки ΔH° 298и ΔG° 298объясняются возрастанием в ходе реакции числа молекул газов и связанным с этим увеличением энтропии. Именно поэтому оказывается возможным самопроизвольное протекание эндотермической реакции восстановления меди.
Пример 3. Вычислить константу равновесия реакции:
NH 3+ HCl = NH 4Cl
Прежде всего определим ΔG° 298реакции. Для этого находим в табл. 7 ΔG° 298NH 3(-16.7 кДж/моль), HCl (-94.8 кДж/моль) и NH 4Cl (-203.2 кДж/моль) при 298 К и производим суммирование:
ΔG° 298= -203,2 -(-16,7 - 94,8) = -91,7 кДж
Теперь найденное значение ΔG° 298подставляем в уравнение (см. стр. 193)
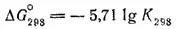
Получаем:
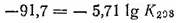
Отсюда
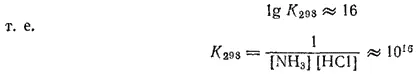
Большое значение найденной нами константы показывает, что при стандартной температуре равновесие
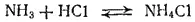
сильно смещено вправо; иначе говоря, при 25°C хлорид аммония — устойчивое соединение.
Глава VII. ВОДА, РАСТВОРЫ
69. Вода в природе.
Вода - весьма распространенное на Земле вещество. Почти 3/4 поверхности земного шара покрыты водой, образующей океаны, моря, реки и озера. Много воды находится в газообразном состоянии в виде паров в атмосфере; в виде огромных масс снега и льда лежит она круглый год на вершинах высоких гор и в полярных странах. В недрах земли также находится вода, пропитывающая почву и горные породы.
Природная вода не бывает совершенно чистой. Наиболее чистой является дождевая вода, но и она содержит незначительные количества различных примесей, которые захватывает из воздуха.
Количество примесей в пресных водах обычно лежит в пределах от 0,01 до 0,1%. Морская вода содержит 3,5% (масс.) растворенных веществ, главную массу которых составляет хлорид натрия (поваренная соль).
Вода, содержащая значительное количество солей кальция и магния, называется жесткой в отличие от мягкой воды, например дождевой. Жесткая вода дает мало пены с мылом, а на стенках котлов образует накипь. Подробнее о жесткости воды см. § 212.
Чтобы освободить природную воду от взвешенных в ней частиц, ее фильтруют сквозь слой пористого вещества, например, угли, обожженной глины и т. п. При фильтровании больших количеств воды пользуются фильтрами из песка и гравия. Фильтры задерживают также большую часть бактерий. Кроме того, для обеззараживания питьевой воды ее хлорируют; для полной стерилизации воды требуется не более 0,7 г хлора на 1 т воды.
Читать дальшеИнтервал:
Закладка:








