Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Фильтрованием можно удалить из воды только нерастворимые примеси. Растворенные вещества удаляют из нее путем перегонки (дистилляции) или ионного обмена (см. § 212).
Вода имеет очень большое значение в жизни растений, животных и человека. Согласно современным представлениям, само происхождение жизни связывается с морем. Во всяком организме вода представляет собой среду, в которой протекают химические процессы, обеспечивающие жизнедеятельность организма; кроме того, она сама принимает участие в целом ряде биохимических реакций.
70. Физические свойства воды.
Чистая вода представляет собой бесцветную прозрачную жидкость. Плотность воды при переходе ее из твердого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает. При нагревании воды от 0 до 4°C плотность ее также увеличивается.
- 198 -
При 4°C вода имеет максимальную плотность, и лишь при дальнейшем нагревании ее плотность уменьшается.
Если бы при понижении температуры и при переходе из жидкого состояния в твердое плотность воды изменялась так же, как это происходит у подавляющего большинства веществ, то при приближении зимы поверхностные слои природных вод охлаждались бы до 0°C и опускались на дно, освобождая место более теплым слоям, и так продолжалось бы до тех пор, пока вся масса водоема не приобрела бы температуру 0°C. Далее вода начинала бы замерзать, образующиеся льдины погружались бы на дно и водоем промерзал бы на всю его глубину. При этом многие формы жизни в воде были бы невозможны. Но так как наибольшей плотности вода достигает при 4°C, то перемещение ее слоев, вызываемое охлаждением, заканчивается при достижении этой температуры, При дальнейшем понижении температуры охлажденный слой, обладающий меньшей плотностью, остается на поверхности, замерзает и тем самым защищает лежащие ниже слои от дальнейшего охлаждения и замерзания.
Большое значение в жизни природы имеет и тот факт, что вода обладает аномально высокой теплоемкостью [4.18 Дж/(г К)]*. Поэтому в ночное время, а также при переходе от лета к эиме вода остывает медленно, а днем или при переходе от зимы к лету так же медленно нагревается, являясь таким образом, регулятором температуры на земном шаре.
* Укажем для сравнения значения удельной теплоемкости некоторых веществ [ Дж/(г К)]: песок 0,79, известняк 0,88, хлорид натрия 0,88, глицерин 2,43, этиловый спирт 2,85
В связи с тем, что при плавлении льда объем, занимаемый водой, уменьшается, давление понижает температуру плавления льда. Это вытекает из принципа Ле Шателье. Действительно, пусть лед и жидкая вода находятся в равновесии при 0°C. При увеличении давления равновесие, согласно принципу Ле Шателье, сместится в сторону образования той фазы, которая при той же температуре занимает меньший объем. Этой фазой является в данном случае жидкость. Таким образом, возрастание давления при 0°C вызывает превращение льда в жидкость, а это и означает, что температура плавления льда снижается.
Молекула воды имеет угловое строение; входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине —ядро атома кислорода. Межъядерные расстояния O-H близки к 0,1 нм , расстояние между ядрами атомов водорода равно примерно 0,15 нм. Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды

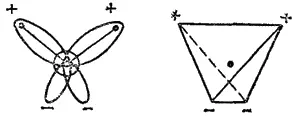
Рис. 71. Схема строения молекулы воды.
- 199 -
Из восьми электронов, составляющих внешний электронный слой атома кислорода в молекуле воды две электронные пары образуют ковалентные связи O-H, а остальные четыре электрона представляют собой две неподеленных электронных пары.
Как уже указывалось на стр. 132, атом кислорода в молекуле воды находится в состоянии sp 3-гибридизации. Поэтому валентный угол НОН (104.3°) близок к тетраэдрическому (109.5°). Электроны, образующие связи O-H, смещены к более электроотрицательному атому кислорода. В результате атомы водорода приобретают эффективные положительные заряды, так что на этих атомах создаются два положительных полюса. Центры отрицательных зарядов неподеленных электронных пар атома кислорода, находящиеся на гибридных sp 3-орбиталях, смещены относительно ядра атома и создают два отрицательных полюса (рис. 71).
Молекулярная масса парообразной воды равна 18 и отвечает ее простейшей формуле. Однако молекулярная масса жидкой воды, определяемая путем изучения ее растворов в других растворителях (см. § 80), оказывается более высокой. Это свидетельствует о том, что в жидкой воде происходит ассоциация молекул, т. е., соединение их в более сложные агрегаты. Такой вывод подтверждается и аномально высокими значениями температур плавления и кипения воды (см. рис. 57 на стр. 148). Как уже говорилось в § 47, ассоциация молекул воды вызвана образованием между ними водородных связей.
В твердой воде (лед) атом кислорода каждой молекулы участвует в образовании двух водородных связей с соседними молекулами воды согласно схеме
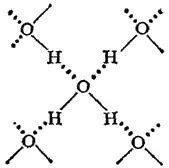
в которой водородные связи показаны пунктиром. Схема объемной структуры льда изображена на рис. 72. Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноименными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной — из соседнего слоя.
- 200 -
Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы H 2O.
При плавлении льда его структура разрушается. Но и в жидкой воде сохраняются водородные связи между молекулами: образуются ассоциаты — как бы обломки структуры льда, — состоящие из большего или меньшего числа молекул воды. Однако в отличие от льда каждый ассоциат существует очень короткое время: постоянно происходит разрушение одних и образование других агрегатов. В пустотах таких «ледяных» агрегатов могут размещаться одиночные молекулы воды; при этом упаковка молекул воды становится более плотной. Именно поэтому при плавлении льда объем, занимаемый водой, уменьшается, а ее плотность возрастает.
По мере нагревания воды обломков структуры льда в ней становится все меньше, что приводит к дальнейшему повышению плотности воды. В интервале температур от 0 до 4°C этот эффект преобладает над тепловым расширением, так что плотность воды продолжает возрастать. Однако при нагревании выше 4°C преобладает влияние усиления теплового движения молекул и плотность воды уменьшается. Поэтому при 4°C вода обладает максимальной плотностью.
Читать дальшеИнтервал:
Закладка:








