Эрик Роджерс - Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра
- Название:Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра
- Автор:
- Жанр:
- Издательство:Мир
- Год:1973
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Эрик Роджерс - Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра краткое содержание
Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Однако было бы неразумно и неудобно получать мел таким способом (если только мы не нуждаемся в особо чистом продукте), поскольку его можно непосредственно добывать в горных карьерах. Откроем секрет, что те вещества, которые использовались в нашем химическом «производстве», вероятно, и были приготовлены из этого натурального мела.
Взяв в качестве исходного сырья мел, мы можем разложить его прокаливанием на углекислый газ и известь. Известь, или окись кальция, — это белый порошок, получающийся при «ржавлении» на воздухе металлического кальция. 100 кг мела дают 56 кг извести и 44 кг углекислого газа. Практически этот процесс используется, конечно, не для получения углекислого газа, а в первую очередь для производства извести, которая необходима для сельского хозяйства и химической промышленности. Известь немного растворяется в воде, образуя слабый горьковатый раствор, содержащий ионы кальция и, вместо ожидаемых ионов кислорода, ионы гидроксила ОН -, которые получаются в результате ее взаимодействия с водой при растворении.
Взяв продукты разложения мела, полученные путем прокаливания (при котором его молекулы как бы разбиваются сильными ударами микроскопических молоточков), мы можем снова соединить их вместе. Известь + углекислый газ опять образуют мел. Однако эту реакцию трудно провести с кусками твердой извести, так как доступ к ней углекислого газа затруднен. Гораздо лучше растворить известь в воде и пропускать углекислый газ через раствор. При этом будут хорошо видны белые облачка образующегося мела [84].
Химические формулы и уравнения
Факты, с которыми мы здесь сталкиваемся, становятся все более сложными и трудными для понимания и запоминания. Химики стараются упростить их, используя лаконичные уравнения, которые показывают, как атомы элементов соединяются или замещают друг друга. Эти уравнения выражают их уверенность в неуничтожимости материи и неизменности составляющих эту материю атомов, которая позволяет им записывать по одинаковому числу атомов одного и того же элемента в обеих частях уравнения. Атомы не исчезают, их «баланс» всегда сходится. Каждый атом мы изображаем одной буквой (или, где это необходимо во избежание неопределенности, двумя буквами). Атом углерода обозначается буквой С, кислорода — буквой О, кальция — буквами Са, хлора — буквами Сl. Для водорода, азота, серы приняты обозначения Н, N, S. Атом натрия записывается Na, что происходит от старого латинского названия поваренной соли natrium, а атом меди Си (от cuprum). Соединение одного атома кальция и одного атома кислорода — окись кальция (известь) обозначается СаО. Если же молекула какого-либо соединения содержит два одинаковых атома, то после их символа пишется индекс 2, например СО 2или H 2SO 4 [85].
Химическое превращение, происходящее при сжигании угля, о котором мы уже говорили, изображается так;
С+ О 2= СО 2
[углерод + кислород дают углекислый газ].
[Один атом углерода соединяется с содержащей два атома молекулой кислорода, образуя одну молекулу углекислого газа.]
Сейчас вы уже накопили достаточно знаний, чтобы догадаться, что атомы кислорода, водорода, хлора и многих других газов объединяются в молекулы по два, т. е. образуют молекулы О 2, N 2и т. д. Действительно, имеются весьма веские основания записывать их именно таким образом (разумность этого, в частности, заключается в следующем: одноатомный водород Н в отличие от двухатомного Н 2отвечает свободному, только что рожденному агрессивному атому водорода, с жадностью вступающему в химические реакции).
Другое, знакомое нам превращение:
CO 2+ H 2 O= H 2 CO 3.
[Одна молекула углекислого газа при растворении соединяется с одной молекулой воды, образуя молекулу угольной кислоты.]
Мы помним также, что Н 2СО 3может расщепляться на ионы водорода Н +, Н +и ион СО 3, т. е. СО 3 -:
H 2 CO 3 H ++ H ++ CO 3 -
При сливании растворов хлористого натрия и угольной кислоты смесь остается совершенно прозрачной, а при смешивании растворов углекислого натрия Na 2CO 3и хлористого кальция СаСl 2мы видим облачко осаждающегося мела:
Na 2 CO 3+ СаСl 2= СаСО 3+ 2 NaCl [86].
Зная, что растворенные вещества могут расщепляться на ионы, осторожный химик написал бы такое уравнение для электрически заряженных ионов и заменил бы знак равенства «=» стрелками 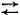 , которые означают, что процесс может протекать в обоих направлениях. Но если бы он заметил, что одна из четырех комбинаций СаСО 3нерастворима, то поставил бы только одну стрелку;
, которые означают, что процесс может протекать в обоих направлениях. Но если бы он заметил, что одна из четырех комбинаций СаСО 3нерастворима, то поставил бы только одну стрелку;
Na 2 CO 3+ CaCl 2—> CaCO 3+ 2 NaCl.
Возьмем теперь наш только что полученный мел СаСО 3 и прокалим его;
CaCO 3 CaO+ CO 2
[мел превращается в известь и углекислый газ].
Здесь стрелки направлены в обе стороны, так как реакция может идти в любом направлении в зависимости от температуры. Растворяясь в воде, известь образует раствор гидроокиси кальция:
CaO+ H 2 O—> Ca( OH) 2
Гидроксильная группа ОН входит в состав самых едких щелочей, хотя сама известковая вода обладает весьма слабыми щелочными свойствами. Опустим в воду небольшой кусочек металлического натрия, и он вырвет атом водорода из молекул этой нейтральной жидкости, образуя сильную щелочь:
Na+ H 2 O—> NaOH+ H
[натрий и вода дают гидроокись натрия и водород].
Выделяющиеся пузырьки газообразного водорода говорят нам о том, что нужно удвоить это уравнение и записать его в виде
2 Na+ 2 Н 2 О—> 2 NaOH+ Н 2.
Гидроокись натрия (каустическая сода, или едкий натр) — это мыльный на ощупь, едкий щелочной раствор, нейтрализующий кислоты
2 NaOH+ H 2 SO 4 —> Na 2 SO 4+ Н 2 О.
[Гидроокись натрия (каустическая сода) + серная кислота (сернокислый водород) дают сернокислый натрий и воду.]
Кислоты
Все кислоты содержат водород и неметаллические элементы (хлор в соляной кислоте, сера и кислород в серной). Для кислот характерно, что входящие в них атомы водорода в водном растворе становятся ионами Н +, придавая ему кислый вкус. (В растворах щелочей в противоположность этому образуются ионы ОН -.)
Распознавать кислоты по их кислому вкусу все же опасно, лучше познакомиться с их другими свойствами. Кислоты способны нейтрализовать щелочи, образуя воду и выделяя тепло. Они реагируют со многими металлами, которые замещают в них водород. Большинство кислот вытесняет углекислый газ из растворов карбонатов.
Читать дальшеИнтервал:
Закладка:








