Эрик Роджерс - Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра
- Название:Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра
- Автор:
- Жанр:
- Издательство:Мир
- Год:1973
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Эрик Роджерс - Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра краткое содержание
Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Можно привести десятки подобных примеров простых соотношений между объемами реагирующих газов. (Конечно, все измерения должны производиться при постоянной температуре и одном и том же давлении, скажем при давлении, равном атмосферному.)
Закон Авогадро
Вскоре после того, как Гей-Люссак указал на то, что объемы вступающих в реакцию газов подчиняются простым соотношениям, итальянский ученый Амадео Авогадро высказал блестящую догадку (~ 1813 г.), что (при любых выбранных температуре и давлении) равные объемы различных газов содержат одинаковое число молекул, т. е. независимо от сорта газа в одном и том же сосуде содержится равное число молекул. Авогадро так убедительно аргументировал свои мысли, что если бы вы прочитали его записи, то сочли бы заключения, сделанные им, неопровержимыми. Данные современной физики (см. гл. 30 ) полностью подтверждают правоту ученого, и мы называем этот закон законом Авогадро .
Применим закон Авогадро к химической реакции, в которой 1 л хлора (N молекул) соединяется с 1 л водорода. Этот пример иллюстрируется фиг. 167.
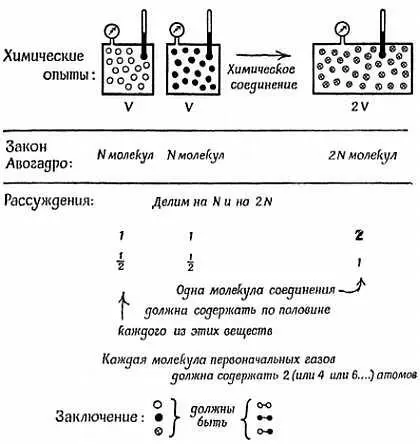
Фиг. 167. Доказательство двухатомного состава молекул водорода, хлора и хлористого водорода.
Опираясь на закон Авогадро, а также на экспериментальные факты, мы приходим к заключению, что одна молекула хлористого водорода содержит половину молекулы водорода и половину молекулы хлора; иными словами, обе эти молекулы должны обладать способностью делиться пополам . Это значит, что молекула водорода может быть Н 2, Н 4или Н 6, но не Н. Останавливаясь на самом простом предположении, будем считать, что она представляет собой Н 2. Это предположение мы могли бы подкрепить соображениями такого рода, которые мы рассматривали, говоря о метане, хотя до сих пор ни один чисто химический эксперимент не исключил полностью возможность того, что правильным ответом было бы Н 4или Н 6. По тем же самым причинам мы считаем, что молекула газообразного хлора должна быть Сl 2. Что же мы можем сказать, основываясь на аналогичных аргументах, о реакции, в которой получается двуокись углерода? Что говорит нам реакция образования воды? Вы можете удостовериться сами, что воду необходимо записывать Н 2О.
В любых химических реакциях, в которых исходными или конечными продуктами являются газы, мы снова и снова встречаемся с простыми соотношениями между их объемами — 1:1, 2:1, 3:2 и т. д. (при условии, что объемы измеряются при постоянных температуре и давлении). Связывая эти экспериментальные факты с законом Авогадро, мы все более убеждаемся в том, что сталкиваемся здесь с образованием или перестройкой молекул: одна молекула дает другую молекулу, из двух молекул получается одна или из трех две и т. д.
Атомные веса
Таким образом, в результате точных измерений масс веществ, участвующих в химических реакциях, а также объемов реагирующих и образующихся газов в науку вошла замечательная атомная гипотеза, т. е. представление о том, что каждый элемент имеет однородные атомы с характерной для них массой и что молекулы — это стандартные, родственные группы атомов . Простота количественных соотношений, которые дала атомная теория, оказала неоценимую помощь развитию химии. Но для широкого количественного использования теории химикам не хватало данных о массах атомов различных элементов, точнее, об их относительных массах, выраженных в некоторой удобной шкале. Эти массы удалось измерить путем тщательного взвешивания веществ, образующих химические соединения.
Относительные массы атомов в шкале, где за единицу принимается масса атома водорода, называются атомными весами . Результаты взвешиваний показали, что для О и Н, входящих в состав воды, соблюдается соотношение 8:1; измерение объемов этих газов показало, что состав молекулы воды — Н 2О; таким образом, атомный вес кислорода должен быть равен 16. Соотношение 23:16:1 для Na, О и Н, входящих в состав гидроокиси натрия, показывает, что ее формула должна быть NaOH, а атомный вес натрия — 23.
К 1810 г. Дальтон исследовал около 20 элементов и приблизительно установил их атомные веса. С этого времени высокое экспериментальное искусство и тщательная логика исследования стали неотъемлемой чертой всех измерений атомных весов. Уже сто лет назад было изучено около трех четвертей из известных нам сейчас почти ста элементов, а их атомные веса измерены с достаточно хорошей точностью.
Если определить химическое соединение как вещество, содержащее составляющие его элементы в неизменных пропорциях, то мы не должны удивляться, узнав, что опыт действительно подтверждает постоянство содержания элементов в любом произвольно выбранном соединении! Итак, поистине удивительные и важные экспериментальные факты заключаются в следующем:
A) Существует бесчисленное количество веществ, каждое из которых обладает постоянным содержанием составляющих его элементов и определенными физическими [89]и химическими свойствами независимо от того, где оно было найдено или каким путем получено. (Если бы лишь немногие из веществ подчинялись этому правилу, то химия была бы совсем иной. Может быть, она оказалась бы и более простой, но, скорее всего, была бы перегружена изобилием разнообразных смесей.)
B) Элементы, входящие в различные соединения, находятся между собой в очень простых весовых соотношениях, указывая тем самым на то, что каждый атом одного и того же элемента имеет постоянную характерную массу независимо от того, в какой химической комбинации он находится [90]. Можно только удивляться, что все химические соединения построены по одинаковой схеме, причем каждый элемент обладает одним и тем же атомным весом во всех соединениях, куда он входит.
Откуда же химик берет уверенность, что при построении таблицы атомных весов он не опустил множитель 1/ 2, или 2, или 3? Если вода была бы НО, то кислород мог бы обладать атомным весом 8, а если гидроокись натрия была бы Na 2OH, то атомный вес натрия стал бы 12,5 (заметим, что сернокислый натрий и в самом деле имеет 2 атома натрия в своей молекуле Na 2SO 4). Если же гидроокись натрия оказалось бы Na(OH) 2, то атомный вес натрия был бы 46. В ряде случаев такие сомнения действительно возникают, но химики разработали хорошие способы разрешать их и находить правильный множитель. Пример с численными соотношениями между объемами газов позволяет принять нужное решение в случае кислорода и воды. Другое эмпирическое правило, установленное Дюлонгом и Пти, помогает определить атомный вес натрия. Это правило гласит, что для большинства элементов, находящихся в твердом состоянии [91],
Читать дальшеИнтервал:
Закладка:








