Эрик Роджерс - Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра
- Название:Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра
- Автор:
- Жанр:
- Издательство:Мир
- Год:1973
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Эрик Роджерс - Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра краткое содержание
Физика для любознательных. Том 3. Электричество и магнетизм. Атомы и ядра - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Как мы уже говорили раньше, при электролизе расплавленного хлористого натрия получаются газообразный хлор и сода в весовой пропорции 71:46. Сжигание углерода [88]в атмосфере кислорода дает СО 2, в котором эти элементы находятся в пропорции 3:8. Если же доступ воздуха к горящему углероду ограничен, то образуется другое соединение — легкий ядовитый бесцветный газ, смесь которого с воздухом взрывоопасна. Этот газ называется окисью углерода (или угарным газом) и содержит углерод и кислород уже в пропорции 3:4. Неизменные пропорции содержания элементов в соединениях легко объяснить на основе представления о существовании однородных атомов каждого составляющего элемента. Это представление становится еще более убедительным, когда мы рассмотрим количественные соотношения между элементами в нескольких различных соединениях. Взгляните на следующую таблицу:

Изучение соотношений между элементами среди большого количества других химических соединений дает аналогичные результаты, которые убедительно подкрепляют атомную гипотезу. Если считать, что весь водород состоит из одинаковых легких атомов, то атомы кислорода будут тяжелее их в 8 или, возможно, в 16 раз, атомы хлора — в 35,5 раза, натрия — в 23 раза и т. д. Мы можем представить молекулу любого химического соединения состоящей из таких атомов. Ясно, что в молекулах различных соединений может присутствовать по нескольку атомов одного элемента. (Например, если гидроокись натрия — это NaOH, то вода будет Н 2О, а если вода была бы НО, а не Н 2О, то гидроокись натрия нужно было бы записать NaO 2H.)
Использование количественной, основанной на опыте атомной теории необычайно облегчило понимание химических процессов и явилось огромным достижением науки. Эта теория в удивительно четкой форме была сформулирована Джоном Дальтоном приблизительно в 1808 г. Новые тщательные измерения и открытия ряда неизвестных элементов, сделанные Берцелиусом, Дэви и многими другими учеными, еще более способствовали ее быстрому прогрессу. Во всех химических процессах атомы вели себя так, что их относительная масса оставалась неизменной. Постоянное подтверждение этого правила в любых измерениях заставляет нас признать, что атомы реально существуют, и, придя к представлению о неизменных массах атомов, мы создали такую стройную концепцию, что нам трудно было бы отказаться от нее, даже если бы вдруг оказалось, что атомы — это только иллюзия!
Если все же наши представления правильны, если простейшие однородные атомы, которые могут объединяться друг с другом в молекулы, существуют, то можно сделать еще один важный вывод: когда одни и те же элементы образуют несколько различных соединений, то количества элементов в этих соединениях должны быть связаны между собой весьма простыми соотношениями. Этот так называемый Закон Кратных Отношений является одним из немногих законов, которые были сначала обнаружены теоретически и лишь затем подтверждены на опыте. Рассмотрим следующую таблицу:

(В этой таблице использованы числовые значения, которые демонстрируют простоту соотношений особенно наглядно. В действительности измерения не дают непосредственно столь простых соотношений.)
Если формулы воды Н 2О, хлористой меди (закисной) CuCl, двуокиси углерода СО 2так просты, то изображаются ли другие вещества столь же простыми формулами?
Даже приведенные примеры не могут окончательно доказать, что атомы действительно существуют. По крайней мере один из выдающихся химиков прошлого столетия утверждал свое право не верить в них, пока, практически только в начале нашего века, эксперименты с атомными частицами (броуновское движение, опыты Милликена по измерению заряда е электрона и отношения заряда к массе e / m электронов и ионов, а также опыты по рассеянию альфа-частиц) не заставили признать атомы безусловно необходимыми для описания материи.
Мы далеки от утверждения, что простым взвешиванием можно измерить относительные массы отдельных атомов. Но как же узнать, в 8 или 16 раз масса атома кислорода больше, чем водорода? Широко известное соединение углерода и водорода — газ метан — содержит их в весовом соотношении 3:1. Можно ли записать метан в виде СН, сказав, что углерод только в 3 раза тяжелее водорода? Химики считают, что на самом деле формула метана СН 4, т. е. соотношение между углеродом и водородом следует записать (4x3):(4х1) = 12:4, иначе говоря, углерод в 12 раз тяжелее водорода. Как удалось сделать такое важное заключение? Эта задача была решена с помощью хитроумного химического приема. Метан был обработан хлором, который заместил в нем водород. Если бы метан содержал по одному атому С и Н, то он превратился бы в ССl. Если же метан — это СН 4, то в нем можно заменить на хлор 1, 2, 3 или даже 4 водородных атома. И в самом деле, действием хлора на метан были получены четыре различных химических соединения. Первое — тяжелый газ СН 3Сl, второе — еще более тяжелый газ СН 2Сl 2, затем жидкость СНСl 3(хлороформ) и, наконец, ядовитая жидкость — четыреххлористый углерод ССl 4.
Вот как распределяются весовые пропорции между элементами в этих веществах:
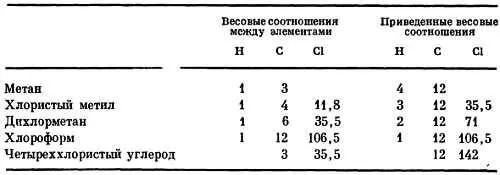
Как только вы разберетесь в этих соотношениях и приведете их к виду, который изображен в правой части таблицы, вам станет ясно, что масса атома углерода должна быть в 12 раз больше массы атома водорода. (Если, конечно, в действительности формула метана СН 8, то атом углерода будет тяжелее не в 12, а в 24 раза. Однако в этом случае можно было бы ожидать появления еще и других хлорзамещенных метана, таких, скажем, как СН 7Сl, которые в действительности не обнаруживаются. Имеются и другие убедительные доказательства, подтверждающие правильность выбора значения 12.)
Вернемся теперь опять к воде. Если ее формула НО, то отношение масс атомов водорода и кислорода 1:8. Почему же мы должны считать, что вода — это Н 2О, т. е. что атом кислорода в 16 раз тяжелее атома водорода. Когда впервые было обнаружено, что вода содержит кислород и водород, ей как раз и приписали состав НО. Эта ошибка была исправлена только с появлением закона Авогадро, что в значительной степени помогло атомной химии прийти к ее современному состоянию.
Объемы газов и химические превращения
Современные методы взвешивания и точные расчеты показывают, что массы элементов относятся приблизительно как целые числа. Однако в прежние времена более легким и очевидным количественным методом было измерение объема газов. Если мы соединим водород и кислород при температуре, скажем, 100 °C и будем поддерживать образующуюся при этом воду в виде пара, то обнаружим, что 2 л водорода соединяются с 1 л кислорода, образуя 2 л пара, или 1 л хлора и 1 л водорода дают 2 л газообразной соляной кислоты, или при горении 2 л окиси углерода расходуется 1 л кислорода и получаются 2 л двуокиси углерода.
Читать дальшеИнтервал:
Закладка:








