А. Березовчук - Физическая химия: конспект лекций
- Название:Физическая химия: конспект лекций
- Автор:
- Жанр:
- Издательство:Конспекты, шпаргалки, учебники «ЭКСМО»b4455b31-6e46-102c-b0cc-edc40df1930e
- Год:2009
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
А. Березовчук - Физическая химия: конспект лекций краткое содержание
Данное учебное пособие предназначено для студентов химических факультетов высших учебных заведений педагогического и технического направления. Изложены основные концепции и процессы, составляющие современную физическую химию. Материал соответствует государственному стандарту. Пособие рекомендовано в помощь студентам при подготовке к экзаменам.
Физическая химия: конспект лекций - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
η a– поляризация анода, В;
η k– поляризация катода, В;
Δ U ЭЛ-ТА– падение напряжения в электролите, В;
Δ U ДИФ – падения напряжения в диафрагме, В;
Δ U КОН – падение напряжения в контактах, В;
Δ U ЭЛ– падение напряжения в электродах, В.
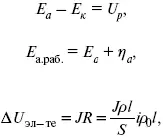
где i – плотность катодного тока;
ρ 0– удельное сопротивление электролита, ρ 0повышается при вводе газа;
l – расстояние между электродами;
S – площадь сечения электролита;
J – электропроводность.
Коэффициент газонаполнения k = ρ/ρ 0 .
Падение напряжения газозаполнения элемента определяется по формуле
Δ U ЭЛ-ТА= ilρ 0 k.
Падение напряжения в диафрагме
Δ U ДИФ= JR ДИАФ .
Падение напряжения в контактах обычно принимают равным 5 – 10% от общего напряжения.
Падение напряжения в электродах:
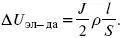
Снижение напряжения на электрохимическом аппарате – оптимальное расстояние между электродами, максимальной электропроводностью.
Рис. 2
К энергетическим характеристикам относятся:
1) напряжение на электрохимическом аппарате;
2) отдача по напряжению.
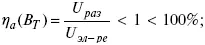
3) отдача по емкости
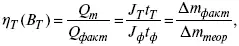
4) отдача по энергии
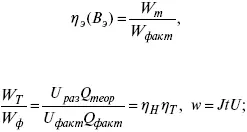
5) производительность электрохимического аппарата оценивается количеством продукта на одной затраченной энергии.
Расход электрической энергии на 1 тонну произведенного продукта определяется так:
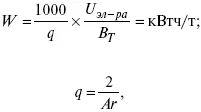
В T– выход по току в долях единицы.
Энергетический баланс– устанавливает соотношение между видом энергии, поступающей в электролизер, и энергией, уходящей из него, демонстрируя равенство статей прихода и расхода. Электроэнергия const тока, подводимая к электролизеру, составляет:
W ЭЛ= UJt.
Общее уравнение энергетического баланса имеет следующий вид:
W э + ∑ Q прихода= W эл.хим.р -ии+ W тока+ ∑ Qрасх ,
где ∑ Q прихода– тепловая энергия, поступающая в электролизер с электролитом и электродами за счет вторичных процессов;
W эл.хим.р -ии– энергия тока, затраченная на электрохимическую реакцию;
W тока– энергия тока, перешедшая в тепловую энергию; ∑ Qрасх – тепловая энергия, уносимая электролитом, электродами, газами при испарении Н 2О, излучении и конвекции.
3. Первый закон термодинамики. Калорические коэффициенты. Связь между функциями C Pи C v
Формулировки первого закона термодинамики.
1. Общий запас энергии в изолированной системе остается постоянным.
2. Разные формы энергии переходят друг в друга в строго эквивалентных количествах.
3. Невозможно построить вечный двигатель первого рода, который бы давал механическую энергию, не затрачивая на это определенное количество молекулярной энергии.
4. Количество теплоты, подводимое к системе, расходуется на изменение U вни совершаемую работу.
5. U вн– функция состояния, т. е. она не зависит от пути процесса, а зависит от начального и конечного состояния системы.
Доказательство:
Пусть ТДС рассматривается при двух параметрах давления и объема, имеется два состояния системы I и II. Нужно перевести систему из состояния I в состояние II либо по пути А, либо по пути В (рис. 3).
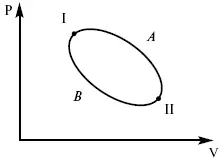
Рис. 3
Предположим, что по пути А изменение энергии будет Δ U A, а по пути В – Δ U B. Внутренняя энергия зависит от пути процесса
Δ U A= Δ U B,
Δ U A– Δ U B≠ 0.
Согласно пункту 1 из формулировок первого закона термодинамики, общий запас энергии в изолированной системе остается постоянным
Δ U A= Δ U B,
U вн– функция состояния не зависит от пути процесса, а зависит от состояния системы I или II. U вн– функция состояния, является полным дифференциалом
Q = Δ U + А –
интегральная форма уравнения первого закона термодинамики.
δ Q = dU + δ A–
для бесконечно малого процесса, δ A– сумма всех элементарных работ.
Калорические коэффициенты
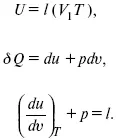
Теплота изотермического расширения:
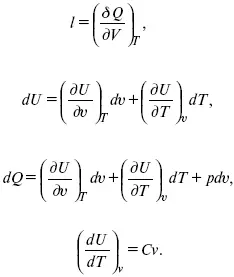
Уравнение первого закона термодинамики в калорических коэффициентах
δ Q = ldv + C vdT,
где l – коэффициент изотермического расширения;
С v– теплоемкость при постоянном объеме.

теплоемкость при const давлении,
δ Q = hd p+ С pdT,
δ Q = χdP + ψpdv.
Связь между функциями C P и C v
δ Q = hd p+ С pdT = ldv + C vdT,
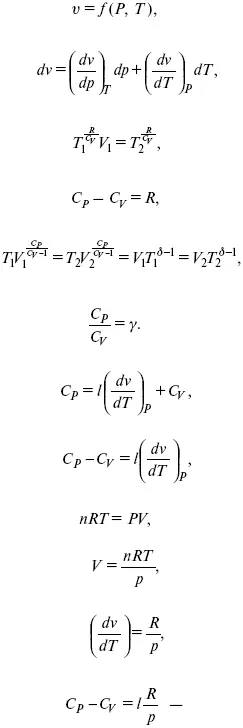
для реального газа.
Для идеального газа l= р
С р– С V= R,
к = ( δ Q/дv)ρ– теплота изохорного расширения;
m = ( δ Q/дP)v– теплота изобарного сжатия.
4. Изопроцессы в термодинамике. Энергия Гельмгольца
1. Изотермический – Т= const
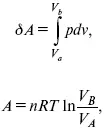
так как
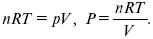
2. Изохорный – V = const
δ А = 0,
δ А = pdυ = 0,
δ Q = dU + pdυ,
δ Q = C vdT.
3. Изобарный – P = const
δ А = pdυ,
A = pV 2– pV 1.
4. Адиабатический– δ Q = 0
1) δ A = –dU,
A = –C V(T 2– T 1), T 2> T 1;
2) pd δ = –CvdT,
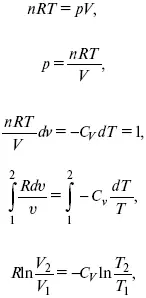
действие, обратное логарифму – потенцирование
Читать дальшеИнтервал:
Закладка:










