А. Березовчук - Физическая химия: конспект лекций
- Название:Физическая химия: конспект лекций
- Автор:
- Жанр:
- Издательство:Конспекты, шпаргалки, учебники «ЭКСМО»b4455b31-6e46-102c-b0cc-edc40df1930e
- Год:2009
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
А. Березовчук - Физическая химия: конспект лекций краткое содержание
Данное учебное пособие предназначено для студентов химических факультетов высших учебных заведений педагогического и технического направления. Изложены основные концепции и процессы, составляющие современную физическую химию. Материал соответствует государственному стандарту. Пособие рекомендовано в помощь студентам при подготовке к экзаменам.
Физическая химия: конспект лекций - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
dF = TdS – pdV – SdT,
F – полный дифференциал.

Увеличение объема приводит к тому, что изохорно-изотермический потенциал уменьшается (тот «минус», который стоит перед Р ). Повышение температуры приводит к тому, что F уменьшается.
δ А равн > δ А неравн
Q = Δ U + A,
A = Q – Δ U,
A = T(S 2– S 1) – (U 2– U 1),
А = F 1– F 2= – Δ F,
А равн = – Δ F –
физический смысл изохорно-изотермического потенциала.
Убыль изохорно-изотермического потенциала равна максимальной работе, производимой системой в этом процессе; F – критерий направленности самопроизвольного процесса в изолированной системе. Для самопроизвольного процесса: AF T г< 0.
Для несамопроизвольного процесса: Δ F T,V > 0. Для равновесного процесса: Δ F T,V = 0.
Δ F V,T ≤ 0.
Изохорно-изотермический потенциал в самопроизвольных процессах уменьшается и, когда он достигает своего минимального значения, то наступает состояние равновесия (рис. 4).
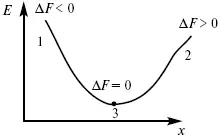
Рис. 4
где 1 – самопроизвольный процесс;
2 – несамопроизвольный процесс;
3 – равновесный процесс.
Изобарно-изотермический потенциал.
1) G (P, Т= cоnst), энергия Гиббса
G = U – TS + PV = H – TS = F + PV,
δ Q = dU – Pdv + A′,
δ A′ = Q – dU – pdv,
δ A′ max = T(S 2– S 1) – (U 2– U 1) – p(V 2– V 1),
δ A′ max = (U 1– TS 1+ PV 1) – (U 2– TS 2+ PV 2) = G 1– G 2= – Δ G,
U – TS + pV = G,
A′ max = – Δ G.
Работа изобарно-изотермического процесса равна убыли изобарно-изотермического потенциала – физический смысл этой функции;
2) функция – полный дифференциал, однозначна, конечна, непрерывна.
G = U – TS + pV,
dG = dU – TdS – SdT + pdv + vdp,
dG = TdS – pdV – TdS – SdT + pdv + vdp,
dG = –SdT + Vdp,
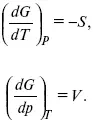
Повышение температуры приводит к тому, что изобарно-изотермический потенциал уменьшается, так как перед S стоит знак «минус». Повышение давления приводит к тому, что изобарно-изотермический потенциал увеличивается, так как перед V стоит знак «плюс»;
3) G как критерий направленности процесса в изолированной системе.
Для самопроизвольного процесса: (Δ G ) P,T < 0. Для несамопроизвольного процесса: (Δ G ) P,T > 0. Для равновесного процесса: ( Δ G) P,T= 0
Δ G (P, T)≤ 0.
Изобарно-изотермический потенциал в самопроизвольных процессах уменьшается, и, когда он достигает своего минимума, то наступает состояние равновесия.
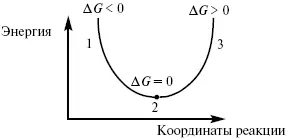
Рис. 5
где 1 – самопроизвольный процесс;
2 – равновесный процесс;
3 – несамопроизвольный процесс.
Совершается работа за счет Δ U и Δ H .
Противодействующие факторы.Энтальпийный фактор характеризует силу притяжения молекул. Энтропийный фактор характеризует стремление к разъединению молекул.
Энтальпия – Н Внутренняя энергия – U.
H = U + PV,
dH = dU + pdv + vdp,
U = TS – PV,
dU = TdS – SdT + pdV + Vdp,
dH = –pdV + pdV + Vdp; U = TdS + VdP.
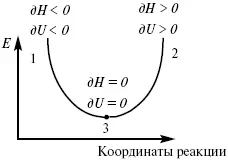
Рис. 6
где 1 – самопроизвольный процесс,
2 – несамопроизвольный процесс,
3 – равновесный процесс,
(dH) P,T≤ 0,
(dU) S,T≤ 0.
Уравнения Гиббса – Гельмгольца – уравнения максимальной работы.
Они позволяют установить связь между максимальной работой равновесного процесса и теплотой неравновесного процесса
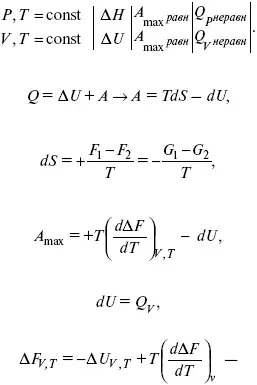
уравнение Гельмгольца (уравнение связывающее функции F и G с их температурными производными).
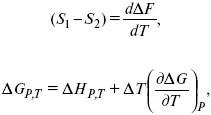
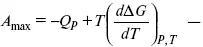
уравнение Гиббса (уравнение связывающее функции F и G с их температурными производными).
Уравнения эти дают возможность рассчитать работу через температурный коэффициент функции Гельмгольца или через температурный коэффициент функции Гиббса.
Уравнение Клаузиуса-Клапейрона
Оно позволяет применить второй закон термодинамики к фазовым переходам. Если рассчитать процессы, в которых совершается только работа расширения, то тогда изменение внутренней энергии
U 2– U 1= T(S 2– S 1) – P(V 2– V 1),
(U 1– TS 1+ PV 1) = (U 2– TS 2+ PV 2),
G 1= G 2– в условиях равновесия.
Предположим, что 1 моль вещества переходит из первой фазы во вторую.
I фаза => dG 1= V 1dp – S 1dT.
II фаза => dG 2= V 2dp – S 2dT, при равновесии dG 2– dG 1= 0
dG 2– dG 1= dp(V 2– V 1) – dT(S 2– S1) –
нет условного равновесия,
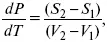
где dP/dT – температурный коэффициент давления,
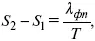
где λ фп– теплота фазового перехода.
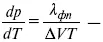
уравнение Клаузиуса-Клапейрона, дифференциальная форма уравнения.
Уравнение устанавливает взаимосвязь между теплотой фазового перехода, давлением, температурой и изменением молярного объема.
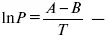
эмпирическая форма уравнения Клаузиуса-Клапейрона.
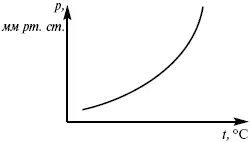
Рис. 7
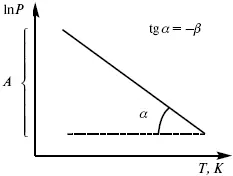
Рис. 8
Уравнение Клаузиуса-Клапейрона изучает фазовые переходы. Фазовые переходы могут быть I рода и II рода.
I рода – характеризуются равенством изобарных потенциалов и скачкообразными изменениями S и V.
II рода – характеризуются равенством изобарных потенциалов, равенством энтропий и равенством молярных объемов.
I рода – Δ G = 0, Δ S ≠ 0, Δ V ≠ 0.
II рода – Δ G = 0, Δ S = 0, Δ V = 0.
Алгебраическая сумма приведенных теплот для любого обратимого кругового процесса равна нулю.
Читать дальшеИнтервал:
Закладка:










