Майкл Файер - Абсолютный минимум. Как квантовая теория объясняет наш мир
- Название:Абсолютный минимум. Как квантовая теория объясняет наш мир
- Автор:
- Жанр:
- Издательство:Питер
- Год:2015
- Город:Санкт-Петербург
- ISBN:978-5-496-01069-6
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Майкл Файер - Абсолютный минимум. Как квантовая теория объясняет наш мир краткое содержание
Физика — это сложнейшая, комплексная наука, она насколько сложна, настолько и увлекательна. Если отбросить математическую составляющую, физика сразу становится доступной любому человеку, обладающему любопытством и воображением. Мы легко поймём концепцию теории гравитации, обойдясь без сложных математических уравнений. Поэтому всем, кто задумывается о том, что делает ягоды черники синими, а клубники — красными; кто сомневается, что звук распространяется в виде волн; кто интересуется, почему поведение света так отличается от любого другого явления во Вселенной, нужно понять, что всё дело — в квантовой физике. Эта книга представляет (и демистифицирует) для обычных людей волшебный мир квантовой науки, как ни одна другая книга. Она рассказывает о базовых научных понятиях, от световых частиц до состояний материи и причинах негативного влияния парниковых газов, раскрывая каждую тему без использования специфической научной терминологии — примерами из обычной повседневной жизни. Безусловно, книга по квантовой физике не может обойтись без минимального набора формул и уравнений, но это необходимый минимум, понятный большинству читателей. По мнению автора, книга, популяризирующая науку, должна быть доступной, но не опускаться до уровня читателя, а поднимать и развивать его интеллект и общий культурный уровень. Написанная в лучших традициях Стивена Хокинга и Льюиса Томаса, книга популяризирует увлекательные открытия из области квантовой физики и химии, сочетая представления и суждения современных учёных с яркими и наглядными примерами из повседневной жизни.
Абсолютный минимум. Как квантовая теория объясняет наш мир - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
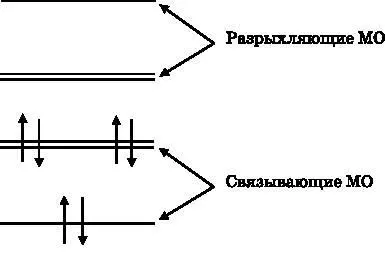
Рис. 18.5. Энергетические уровни молекулярных π- орбиталей бензола с размещёнными на них шестью электронами, занимающими низшие доступные энергетические уровни при соблюдении принципа Паули
Углерод-углеродная связь порядка 1,5
На рис. 18.5 видно, что шесть p z-электронов углерода занимают три π-связывающие МО. Таким образом, имеются три π-связи, разделяемые шестью атомами углерода. Эти три π-связи добавляются к σ-связям, которые соединяют каждые два соседних атома углерода. Всего в результате у каждого атома углерода имеется 1,5 связи с соседними атомами: три π-связи разделяются шестью атомами углерода, внося в их соединения по половине связи. Такие связи между атомами углерода короче и сильнее одиночных углерод-углеродных связей, но они не настолько коротки и сильны, как настоящие двойные связи. π-связи фиксируют плоскую форму молекулы. Изгибы кольца, уводящие его от плоской формы, уменьшают перекрытие p z-орбиталей и повышают энергию. На рис. 18.6 изображена молекулярная диаграмма бензола. Атомам углерода соответствуют вершины. Атомы водорода находятся на свободных концах отрезков, отходящих от углерода. Окружность обозначает систему делокализованных π-электронов.
Углеродные кольца с делокализованными π-связями входят во многие молекулы. Примером может служить нафталин, изображённый на рис. 18.7. Нафталин содержит десять атомов углерода, образующих два кольца по шесть атомов, к которым присоединены восемь атомов водорода. Две окружности изображают делокализованные молекулярные π-орбитали. Как и бензол, нафталин является плоским, а каждый атом углерода в нём имеет полторы связи с соседними атомами углерода.
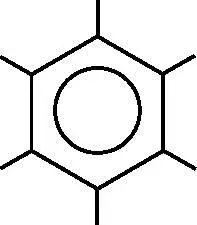
Рис. 18.6. Молекулярная диаграмма бензола. В каждой вершине находится атом углерода, а атомы водорода располагаются на свободных концах отрезков, отходящих от углерода. В виде окружности изображены делокализованные молекулярные π- орбитали
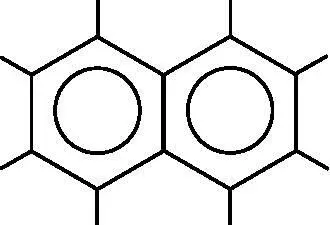
Рис. 18.7. Молекулярная диаграмма нафталина. Нафталин содержит десять атомов углерода и восемь атомов водорода. Окружности изображают делокализованные молекулярные π- орбитали
Бензольные делокализованные молекулярные пи-орбитали
Бензол, нафталин и другие подобные молекулы называют ароматическими. Обычно они имеют приятный аромат. Нафталин используется против моли и имеет характерный запах. Духи содержат более сложные ароматические молекулы, в которые входит множество бензолоподобных колец, а также другие химические группы вместо атомов водорода. Небольшие изменения в молекулярной структуре приводят к изменению аромата, и именно поэтому разные духи пахнут по-разному.
В главе 8 мы обсуждали задачу о частице в ящике. На рис. 8.4 и 8.6 изображены волновые функции и энергетические уровни частицы в ящике. Волновая функция, связанная с низшим энергетическим уровнем, не имеет узлов. На следующем энергетическом уровне волновая функция имеет один узел, на следующем — два узла и т. д. Узел — это место, где волновая функция обращается в нуль, то есть вероятность обнаружить электрон равна нулю. Частица в ящике — это одномерная задача. Узел является точкой. В главе 10 мы анализировали волновые функции и энергетические уровни атома водорода. На рис. 10.2 и 10.6 изображены волновые функции атома водорода для состояний 1s, 2s и 3s. Эти волновые функции трёхмерные. Низшее энергетическое состояние (1s) не имеет узлов, следующее по энергии состояние (2s) имеет волновую функцию с одним узлом. Ещё более высокое энергетическое состояние (3s) имеет два узла. Эти узлы представляют собой трёхмерные поверхности, на которых вероятность обнаружения электрона равна нулю.
У бензольных π-МО число узлов также возрастает с увеличением энергии. На рис. 18.8 схематически изображены бензольные π-МО. Серым тоном показаны области высокой электронной плотности (высокой вероятности обнаружения электронов) для π-МО.
Эти трёхмерные электронные облака продолжаются над плоскостью страницы и за ней и не имеют чётких границ. Также показаны энергетические уровни шести p z-электронов, которые заполняют связывающие МО с наименьшей энергией. МО с минимальной энергией не имеет узлов. Имеются два состояния со следующей по величине энергией. Обе такие МО имеют по одному узлу. Три МО без узлов и с одним узлом являются связывающими. Есть также два уровня со следующим по величине значением энергии. Эти МО имеют по два узла. МО с наивысшей энергией имеет три узла. Эти три МО, имеющие по два и три узла, являются разрыхляющими.
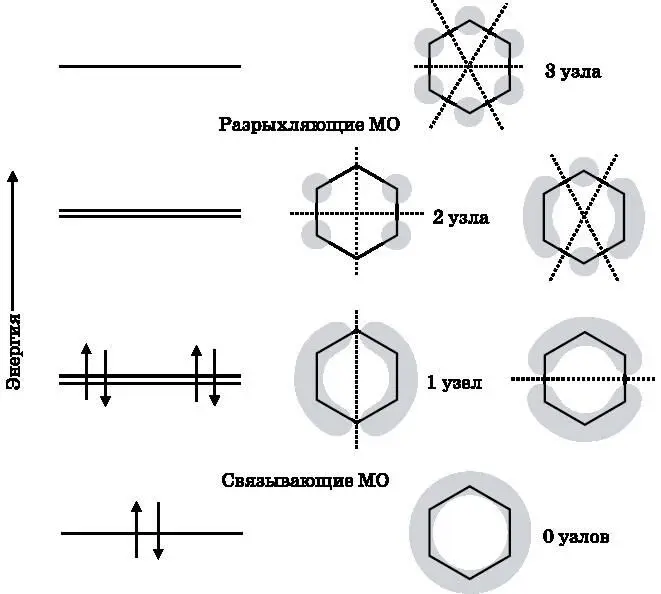
Рис. 18.8. Энергетические уровни бензольных молекулярных π- орбиталей и схематическое изображение формы соответствующих МО. С увеличением энергии число узлов тоже возрастает. МО с одинаковым числом узлов имеют одинаковую энергию
Сравнивая схемы МО с наименьшей и наибольшей энергией на рис. 18.8, нетрудно увидеть, почему первая МО является связывающей, а вторая — разрыхляющей. У МО с наименьшей энергией электронная плотность распределена между всеми атомами углерода. У разрыхляющей МО с наибольшей энергией между всеми атомами углерода находятся узлы, так что электроны на этой МО не будут связывать атомы углерода друг с другом. Две другие связывающие МО хотя и имеют более высокий энергетический уровень, чем связывающая МО с наименьшей энергией, в итоге всё же соединяют атомы углерода. Каждая из этих МО имеет по одному узлу. Та из них, что изображена слева, помещает электронную плотность между парами атомов углерода, находящимися слева и справа. МО, изображённая справа, помещает электронную плотность между тремя атомами углерода вверху и между тремя атомами углерода внизу. Несмотря на узлы, эти МО объединяются с МО, имеющей наименьшую энергию, и порождают три π-связи, которые разделяются между всеми шестью атомами углерода. Две вырожденные разрыхляющие МО имеют каждая по два узла. Та из них, что изображена слева, очевидно, не даёт вклада в связывание, поскольку не размещает электронную плотность между какими-либо двумя атомами углерода. МО, изображённая справа, хотя и помещает электронную плотность между двумя парами атомов углерода, но в совокупности с левой орбиталью не даёт связывания.
Читать дальшеИнтервал:
Закладка:










