Ричард Фейнман - 4. Кинетика. Теплота. Звук
- Название:4. Кинетика. Теплота. Звук
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ричард Фейнман - 4. Кинетика. Теплота. Звук краткое содержание
4. Кинетика. Теплота. Звук - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:

Заметим также, что поскольку уравнение содержит числа в единичном объеме и если мы поставим два опыта с одним и тем же полным числом N атомов и ионов, т. е. со строго определенным числом ядер, но заключим их в ящики разных объемов, то числа n будут меньше для больших ящиков. Однако отношение n en i/n aдолжно оставаться постоянным, поэтому полное число электронов и ионов должно быть больше в большем ящике. Чтобы убедиться в этом, предположим, что в ящик объема V помещено N ядер и их f -я часть ионизована. Тогда n e =fN/V=n i и n a=(1- f)N/V. В этом случае наше уравнение принимает вид
Иначе говоря, если мы берем все меньшую и меньшую плотность атомов или непрерывно увеличиваем объем ящика, относительное число электронов и ионов должно возрасти. То, что ионизация может быть вызвана просто «расширением», при котором плотность уменьшается, объясняет нам, почему при очень малых плотностях (какие встречаются в холодном межзвездном пространстве) много ионов, хотя это трудно понять, учитывая имеющуюся в нашем распоряжении энергию. Энергия во много-много раз больше kT, но ионы все равно есть. Почему же ионы могут существовать лишь при условии, что вокруг них имеется много места, тогда как при увеличении плотности они стремятся исчезнуть? Ответ: Все дело в атомах. Время от времени свет или другой атом, или ион, или еще что-то, что поддерживает тепловое равновесие, разрушает атомы. Очень редко, потому что для этого требуются огромные количества избыточной энергии, электрон отрывается и происходит превращение атома в ион. Если пространства огромны, то электрон слоняется очень долго, быть может много лет и ничего не встречает. Но однажды он находит ион, и тогда они объединяются в атом. Скорость, с которой электроны покидают атомы, очень мала. Но если объем огромен, то сбежавший электрон так долго ищет ион, с которым он мог бы рекомбинировать, что вероятность рекомбинации совсем ничтожна; поэтому, несмотря на то, что для ионизации нужны большие излишки энергии, число электронов может быть вполне ощутимым.
§ 4. Химическая кинетика.

При химических реакциях происходит нечто похожее на «ионизацию». Например, два вещества А к В комбинируют в основном веществе АВ; тогда, подумав немного, мы можем АВ назвать атомом (В — то, что мы называем электроном, а А — то, что мы называем ионом). После такой замены, как и раньше, можно написать уравнение равновесия
Эта формула, конечно, неточна, потому что «постоянная» с зависит от того, в каком объеме позволено объединяться А и В и т. п., но, обратясь к термодинамическим аргументам, можно придать смысл величине W в экспоненциальном множителе, и тогда окажется, что она тесно связана с энергией, необходимой для реакции.
Попробуем понять эту формулу как результат столкновений, приблизительно так же, как мы постигали формулу испарения, подсчитывая электроны, вырывающиеся в пространство, и те, которые возвращаются назад за единицу времени. Предположим, что при столкновениях А и В иногда образуют соединение АВ. И предположим еще, что АВ — это сложная молекула, которая участвует в общей пляске и по которой ударяют другие молекулы, причем время от времени она получает энергию, достаточную для того, чтобы взорваться и снова развалиться на части А и В.
Заметим, что в химических реакциях дело обстоит так, что если сближающиеся атомы имеют слишком малую энергию, то, хотя этой энергии и достаточно для реакции
А+В®АВ, факт соударения атомов А и В еще не обязательно означает начало реакции. Обычно требуется, чтобы соударение было более «жестким», «мягкого» соударения между А и В может оказаться недостаточно для начала реакции, даже если в процессе освобождается достаточное для реакции количество энергии. Предположим, что общей чертой химических реакций является требование, по которому для объединения А и В в АВ недостаточно простого соударения, а нужно, чтобы они столкнулись, имея определенное количество энергии. Эта энергия называется энергией активации, т. е. энергия, нужная для «активации» реакции. Пусть А*— тот избыток энергии, который необходим, чтобы столкновения могли вызвать реакцию. Тогда скорость R f , с которой А и В порождают АВ, должна содержать произведение числа атомов А и B, умноженное на скорость, с которой отдельный атом ударяется о некоторую площадку величиной s ab , и на величину ехр(- A*/kT) (вероятность того, что атомы обладают достаточной энергией):
R f =n A n B vs AB e -A*/kT . (42.10)
Теперь надо найти скорость обратного процесса R r . Есть некоторая вероятность, что А и В снова разойдутся. Чтобы разойтись, им недостаточно энергии W, которая обеспечит их раздельное существование. Но раз молекулам нелегко соединиться, должен существовать некий барьер, через который А и В должны перевалить, чтобы разлететься. Они должны запастись не только нужной для их существования энергией, но и взять кое-что про запас. Получается что-то вроде подъема на холм перед спуском в долину; сначала приходится вскарабкаться на высоту, потом спуститься, и только после этого разойтись (фиг. 42.1).
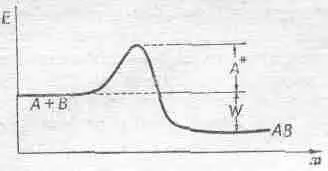
Фиг. 42.1. Соотношение энергий в реакции А+В®АВ.
Таким образом, скорость перехода АВ в А и В пропорциональна произведению n АВ — начальному числу молекул АВ на
ехр[- (W+A*)/kT]:
R r =c'n AB e -(W+A*)/kT) . (42.11)
Постоянная с' складывается из объема атомов и частоты столкновений; ее можно получить, как и в случае испарения,
перемножая площадь и толщину слоя, но сейчас мы этого делать не будем. Сейчас нас больше интересует тот факт, что, когда эти скорости равны, их отношение равно единице. Это говорит о том, что, как и раньше, (n а n в /n ав )=c ехр(- W/kT), где с содержит сечения, скорости и другие множители, не зависящие от чисел п. Интересно, что скорость реакции по-прежнему изменяется как ехр(-const/ kT ), хотя эта постоянная уже не имеет никакого отношения к той, с которой мы встречались в задаче о концентрациях; энергия активации А* сильно отличается от энергии W. Энергия W регулирует пропорции А, В и АВ, при которых устанавливается равновесие, но если нам захочется узнать, быстро ли А+В переходит в АВ, то это уже к равновесию отношения не имеет, и появляется уже другая энергия, энергия активации, которая с помощью экспоненты управляет скоростью реакции.
Читать дальшеИнтервал:
Закладка:



![Ричард Фейнман - Фейнмановские лекции по физике. Современная наука о природе [litres]](/books/1068056/richard-fejnman-fejnmanovskie-lekcii-po-fizike-sov.webp)

