Михаил Бармин - Общая и Неорганическая химия с примерами решения задач
- Название:Общая и Неорганическая химия с примерами решения задач
- Автор:
- Жанр:
- Издательство:Литагент Selfpub.ru (искл)
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Бармин - Общая и Неорганическая химия с примерами решения задач краткое содержание
Общая и Неорганическая химия с примерами решения задач - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
исходных реагентов. Взаимодействие возможно только тогда, когда энергия активных частиц больше или равняется Ea. Однако, известны в химии реакции, сопровождающие образование конечных продуктов без образования переходного состояния (туннельный эффект).
Зависимость скорости химических реакций от катализатора
Катализатором (К) называется химическое вещество, изменяющее скорость химических реакций. Катализатор, уменьшающий скорость химических реакций, называется ингибитором (И).
Различают гомогенный и гетерогенный катализ. В случае гетерогенного катализатора взаимодействие происходит на по-верхности катализатора, гомогенного – активность вещества определяется в реакционном объеме.
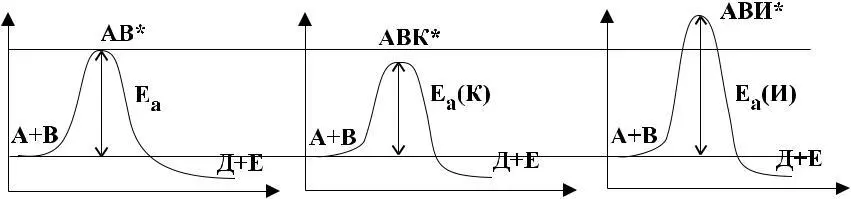
При взаимодействии реагентов в присутствии катализатора, образуется новое переходное состояние, включающее в свою структуру катализатор, В этом случае при повышении скорости химической реакции происходит уменьшение энергии активации (Е), а при применении ингибитора (Е) – увеличивается, по сравнению с (Е) исходных реагентов без применения катализатора. То есть катализатор в переходном состоянии с исходными реагентами образует систему новых химических связей.
Катализаторы обладают избирательным или селективным свойством, что для одних и тех же исходных реагентов приводит к образованию различных продуктов реакции:
C2H5OH T = 300°C
H2O + C2H4
Al2O3
T = 300°C
O
C2H5OH
H2O + CH3 – C
Al2O3
H



В настоящее время не существует единой теории катализа, поэтому в основном в химии при подборе катализатора используются экспериментальные методы. Одним из недостатков этого метода является отравление катализатора. При выборе того или иного катализатора необходимо избавляться от каталитических ядов.
ЛЕКЦИЯ 7.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
План:
Реакции обратимые и необратимые.
Правило Бертолле.
Принцип Ле-Шателье.
В химии известны реакции двух типов:
необратимые химические реакции (идущие до конца).
обратимые химические реакции
К необратимым можно отнести такие реакции, которые со-провождаются выделением газообразных, труднорастворимых или мало диссоциирующих химических соединений.
Ba Cl2 + Na2SO4 → BaSO4↓ + 2NaCl
Zn + HNO3 конц → Zn(NO3)2 + 2NO2↑ + 2H2O
NaOH + HCl → H2O + NaCl
Другие реакции следует отнести к обратимым реакциям. Впервые на обратимые реакции обратил внимание Бертоле при
получении поваренной соли из морской воды
Na2SO4 + MgCl2 <=> 2NaCl + MgSO4
Впервые знак обратимости химический реакций был введен
Вант-Гоффом.
Рассмотрим в общем виде обратимую реакцию:
А + В
V1
C + Д
V 2
V1
= V2
; V1
= k1
= K2 • CC • CД
• CA • CB ; V2
k 1
• CA
• CB = k2 • CС
• C Д
K = k1 /k2
= (CA • CB )/(CС • CД )

Изменение концентрации исходных реагентов А и В в зави-
симости от времени. Таким образом, химическое равновесие при взаимодействии достигается тогда, когда скорость прямой реакции будет равна скорости обратной.
Такие значения концентрации получили название равновесных концентраций. Константа химического равновесия (K) – равна отношению константы прямой реакции к константе обратной реакции или равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных соединений.
Константа химического равновесия зависит от природы реа
гирующих веществ, природы растворителя, от температуры.
В том случае, когда константа прямой реакции будет изменяться в большей степени в зависимости от температуры, чем константа обратной реакции, то и константа химического равновесия будет увеличиваться с увеличением температуры. Кон-
станта химического равновесия не зависит от исходной концентрации реагирующих веществ.
Константа химического равновесия представляет собой постоянную величину, т.е. имеет фиксированную величину при определенном значении температуры. Катализатор не оказывает влияния на величину К. и не изменяет выход обратимой реакции.
Если К>>1, то равновесие химической реакции практически смещено в сторону образования продуктов, если К<<1, то хи-
мическое равновесие смещено в сторону исходных реагентов.
2С(тв) + O2(2)
K1
2CO(2)
K2
/ [O2]
K. = K1 /K 2 = [CO] 2
При написании уравнений для К. необходимо использовать
значение равновесных концентраций.

Если же концентрация молекул практически не изменяется (твердые вещества) значение концентрации принимается постоянным и не вводится в уравнение концентрации равновесия.
Смещение химического равновесия. Принцип Ле-Шателье.
Смещение химического равновесия можно достигнуть несколькими путями:
1) изменением температуры. Известно, что константа химического равновесия имеет фиксированное значение при определенной температуре.
Q – 3H2 + N2 <=> 2NH3 + 92 кДж/моль ΔH0298 = -92 кДж/моль
Таким образом, для данного экзотермического процесса охлаждение системы приводит к смещению химического равновесия в сторону образования аммиака. При повышении температуры химическое равновесие системы смещается вправо, поскольку данная реакция является эндотермической.
2) Изменение концентрации.
3KCNS + FeCl3
K1
Fe(CNS)3
+ 3KCl
K2
K =
K
1
=
[Fe(CNS)
3
] • [KCl]3
K
[KCNS]3
]
2
• [FeCl3

При взаимодействии исходных реагентов образуется ру-биново-красное окрашивание раствора (цвет Fe(CNS)3). При
добавлении к равновесной системе избыточного количества KCNS или FeCl3 видим, что интенсивность окраски воз-растает, т.е. произошло смещение химического равновесия вправо.
При добавлении к равновесной системе избыточного коли-чества KCl интенсивность окраски уменьшается, т.е. равнове-сие сместилось в сторону исходных реагентов.
В 1 случае при постоянном значении константы равновесия происходит изменение (увеличение значения равновесной концентрации в знаменателе уравнения). Эти изменения приводят к увеличению значения равновесной концентрации конечных продуктов реакции.
Во 2 случае происходит увеличение равновесной концентрации в числителе уравнения, что в свою очередь вызывает увеличение равновесной концентрации конечных продуктов, т.е. равновесие смещается в сторону исходных реагентов.
Читать дальшеИнтервал:
Закладка:










