Михаил Бармин - Общая и Неорганическая химия с примерами решения задач
- Название:Общая и Неорганическая химия с примерами решения задач
- Автор:
- Жанр:
- Издательство:Литагент Selfpub.ru (искл)
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Бармин - Общая и Неорганическая химия с примерами решения задач краткое содержание
Общая и Неорганическая химия с примерами решения задач - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
протекает в кислой среде).
NO2– + H2O → NO3– + 2H+
Теперь уравниваем сумму зарядов слева и справа. Восстановитель – NO2– + H2O – 2e → NO 3– + 2H+ – окисле
ние.
Аналогичные операции проводим для ионного уравнения
перехода перманганат-иона в двухвалентный ион марганца: окислитель – МпO4– + 8H+ + 5e = Мп2+ + 4Н2О – восстановление.
Как и по закону сохранения массы сумма электронов отдан-ных восстановителем должна равняться сумме зарядов приня-тых окислителем, поэтому:
5NO2– + 5H2O – 10ē → 5NO3– + 10H+
2МпO4– + 16H+ + 10ē = 2Мп2+ + 8Н2О
и подставляя в уравнение, сокращая одноименные ионы и мо
лекулы:
5KNO2 + 2KMnO4 + 3H2SO4 = 5KNO3 + 2MnSO4 + K2SO4 + 3H2O
В конце проверяем правильность составления по равенству атомов кислорода в левой и правой части ОВР.
Растворение металлов.
Образование двойного электрического слоя.
Растворимость одного вещества в другом – свойство, присущее всем веществах. Растворимость может быть неограниченной и крайне малой, что зависит от термодинамических свойств растворяемого вещества и растворителя. Даже при чрезвычайно малой растворимости одного вещества в другом всегда имеет место переход веществ через поверхность их контакта. Любой металл растворяется в воде, однако, растворимость в ряду металлов изменяется в очень широких пределах. Например, щелочные металлы бурно взаимодействуют с водой, при этом из воды образуется водород, а в растворе – гидроксиды металлов:
2M + 2H2O → 2MOH + H2 + Q
Серебро практически не реагирует с водой, тем не менее, процесс перехода частиц серебра в воду происходит, и получается так называемая “серебряная вода”. Таким образом, одни металлы активно растворяются в воде, другие – крайне мало.
Ответ на вопрос, чем обусловлена различная растворимость металлов в воде, дает отрасль химической науки – электрохимия.
Рассмотрим особую группу гетерогенных процессов – электрохимические реакции, протекающие на границе раздела фаз, в частности металл – вода (или раствор соли металла). Эти реакции характеризуются переносом заряда и вещества через границу раздела фаз твердое вещество – жидкость.
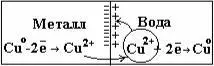
Из медной пластинки -Cu2+ ионы переходят в воду. При этом
кристаллической решетке металла окажется избыток электронов и пластина приобретает отрицательный заряд. Между отрицательно заряженной пластиной и перешедшими в раствор положительными ионами возникает электростатическое притяжение, что препятствует дальнейшему переходу ионов меди в раствор, т.е. процесс растворения металла прекращается.
Одновременно развивается противоположный процесс: ионы меди из раствора, подойдя к поверхности пластины, принимают от нее электроны и переходят в нейтральное состояние.
Через некоторое время устанавливается состояние динамического равновесия, при котором скорость перехода ионов из металла в раствор равна скорости разряжения ионов из раствора на металле.
При контакте металла с раствором его соли , эти две со-прикасающиеся фазы приобретают противоположные заряды,
результате на поверхности раздела фаз образуется двойной электрический слой и между металлом и раствором возникает разность электрических потенциалов. Система, состоящая из электрического проводника и раствора (или расплава) электролита, в который погружен проводник, называется электродом.
Так, медная пластина, опущенная в водный раствор СuSО4 – типичный электрод.
Состояние равновесия электродного процесса определяется электродным потенциалом E представляющим собой разность потенциалов на границе металл – электролит. Непосредственно измерить абсолютное значение электродного потенциала нельзя, но его можно определить сравнением с известным потенциалом другого электрода при стандартных условиях –
электрода сравнения. В качестве электрода сравнения применяют водородный электрод.
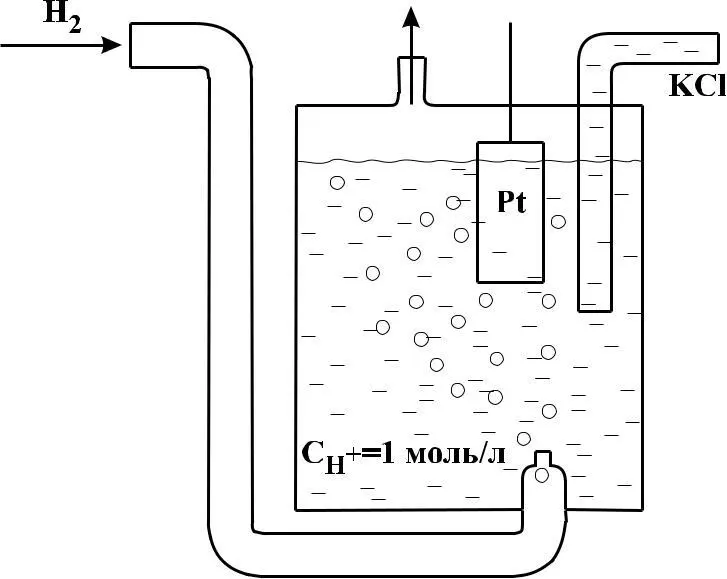
Водородный электрод. Схема гальванического элемента (Сu/H2). Стандартный электродный потенциал.
Водородный электрод представляет собой платиновую плас-тину, опущенную в раствор кислоты (обычно HCl или Н2SО4, через который пропускается газообразный водород
Рис. 1 – Принципиальная схема водородного электрода
Действие этого электрода соcтоит в следующем:
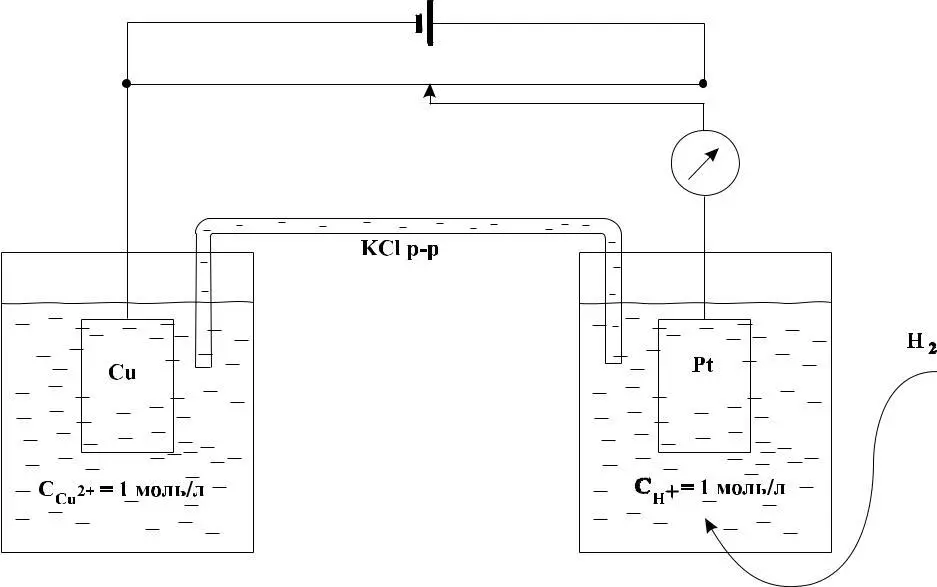
Рис. 2 – Схема гальванического элемента, состоящего из медного и водородного электродов
Газообразный водород не проводит электрического тока, но, адсорбируясь в водном растворе на поверхности платины, ведет себя как электрод, аналогичный металлическому. Для увеличения адсорбирующей способности платину покрывают слоем губчатой платины (платиновой чернью). Платиновую пласти-ну опускают в раствор кислоты (обычно HCl или Н2SО4) с концентрацией (активностью) ионов водорода, равной единице, и через раствор пропускают водород так, чтобы происходило непрерывное соприкосновение поверхности пластины с раствором и водородом. В результате платина насыщается водородом. Молекула водорода в адсорбированном состоянии распадается на атомы, которые ионизируются (Н – ē → Н+), и ионы Н+ переходят в раствор подобно ионам металла. Одновременно ионы водорода из раствора, находящиеся вблизи поверхности платины, принимают электроны (Н+ + ē → H). Между этими процессами устанавливается равновесие, которое в упрощенной форме можно передать уравнением: Н+ + ē = 1/2H2.
Заряд платиновой пластины зависит от парциального давления водорода, концентрации ионов водорода в растворе и температуры. Потенциал водородного электрода при концентрации (активности) в растворе ионов Н+, равной 1 моль/л, давлении газообразного водорода в 101325 Па и при температуре 25° С (стандартные условия) принят равным нулю.
Электрод, потенциал которого сравнивается с потенциалом водородного электрода, должен находиться при тех же условиях. Потенциал электрода, измеренный при стандартных условиях, т.е. при температуре 25° С, давлении 101325 Па и активности ионов в растворе, равной единице, называется стандартным электродным потенциалом (обозначение Е°).
Электродвижущая сила (ЭДС).
При измерении потенциала изучаемого электрода, например медного, медную пластину (с отходящим от нее проводником) опускают в раствор, содержащий ионы Си2+ с концентрацией (активностью) 1 моль/л, и эту систему соединяют электроли-тическим мостиком со стандартным водородным электродом (рис. 2 ). Электролитический мостик – это П-образная стеклянная трубка, заполненная проводящим электрический ток раствором – обычно насыщенным раствором КСl. Полученное устройство называется гальванической цепью, или гальваническим элементом.
Читать дальшеИнтервал:
Закладка:










