Михаил Бармин - Общая и Неорганическая химия с примерами решения задач
- Название:Общая и Неорганическая химия с примерами решения задач
- Автор:
- Жанр:
- Издательство:Литагент Selfpub.ru (искл)
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Бармин - Общая и Неорганическая химия с примерами решения задач краткое содержание
Общая и Неорганическая химия с примерами решения задач - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Большая роль Чугаева как одного из основателей нового направления в аналитической химии связана с установлением понятия о конкретной функционально-аналитической группировке, позволяющего судить о том, какие именно функциональные группы участвуют в образовании координационных связей. В настоящее время на образовании К.С. основаны гравиметрический, волюметрический, фотометрический, экстракционный и другие методы анализа.
Явление комплексообразования используют для маскировки конкретных ионов, для переведения отдельных ионов в осадок в виде малорастворимых соединений или для удерживания их в растворе.
С помощью комплексов металлов удается определять не только отдельные органические соединения, но и их изомерные формы.
М.Пейроне получено соединение цис-Pt(NH3)2CI2, играющее в настоящее время важную роль в химиотерапии рака
(1845г.).
В середине нашего столетия создавались новые отрасли химической индустрии и цветной металлургии. Это отрасли по производству редких и рассеянных хищнических элементов и материалов, на их основе. Во многих случаях задачи решались при использовании конкретных К. С.
Примечательно высказывание выдающегося английского хи-мика Дж.Чатта: «Возможно, не случайным было и то, что единственная страна, которая посвятила значительную часть своих усилий в области химических исследований в 20-х и 30-х годах разработке координационной химии, была и первой страной, пославшей ракету на Луну».
Огромную роль сыграли соединения платиновых металлов
развитии координационной химии. И, наоборот, развитие ее как самостоятельной науки позволило разработать технологии промышленного получения платиновых металлов: палладия, родия, рутелия, иридия, осмия.
Важно отметить, что смешанные оксиды на основе платиновых металлов обладают кроме высокой электрической проводимости, высокой химической стойкостью (не растворяются
«царской водке») и термической устойчивостью. Ведутся работы по замене серебра в светочувствительных композициях. Новейшие сведения в этой области химии в рамках нового научного направления представлены в нашей монографии (см. список литературы).
ЛЕКЦИЯ 14
ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ
И ИХ СОЕДИНЕНИЙ
ПЕРСПЕКТИВЫ ЗАМЕНЫ МЕТАЛЛОВ
План:
1.Расположение в таблице, нахождение в природе, получение и химические свойства металлов. Технологии обработки металлов.
Пластики и полимеры.
Новые методы синтеза.
Заключение.
1. Расположение в периодической системе.
1 – щелочные
nS1
C.O+1S-металлы
II – Ве, Мо, щелочно-
nS2
+2
земельные
III – Al , п/ер,
nS2np 1
+3
nS2np 2
+2,+4
IV – п – гр. Уе
nS2np 3
+3,+5
V – Sb, Bi
nS2(n-1)d1-10
+2
до Comax = N гр D
III-VIII -II B
nS2(n-1)d1(n14-2)f1-14
+3
до +7 – f металлы
2. Нахождение в природе.
Аl(8,45 % по массе)-Fе (4,4 %-Са(3,3 %)-Nа(2,6 %)-К(2,5%)-Mg(2,1 %).
Благородные – в самородном состоянии; остальные в виде руд:
оксиды – Fe 3O4, Al2O3, TiO2, MnO2 сульфиды – Cu2S, ZnS, FeS2, PbS
3. Способы получения.
Пирометаллургические:
I. Собственно пирометаллургия
1. обжиг 2Сu S + 3O2 = 2CuO + 2SO2
2. восстановление СиО + C = Cu ↑ + CO (карботермия)
CuO + CO = Cu + CO2
CuO + H2 = Cu + H2O (гидротермия)
3СuO + 2Al = 3Cu + Al2O3 (металлометрия)
II. Пироэлектрометаллургия
K(-)А13+ + 3ē → Аl° (расплав).
III. Хлорная металлургия: ТiС14 + 2Мg = 2MgCl2 + Ti
IV. Термический диссоциация летучих соединений
Ni(CO)4 = Ni + 4CO; TiJ4 = Ti° + 2J2
Гидрометаллургические:
I. Химический способ
Ag2S + 4KCN = 2K[Ag(CN )2] + K2S
2K [Ag(CN )2] + Zn = K2[Zn(CN )4] + 2Ag
II. Пироэлектрометаллургия
К(-)Ni2+ + 2ē → Ni°(раствор)
Физические свойства.
I. Три типа кристаллических решеток:
гексагональная (к.ч. = 12)
кубическая гранецентрированная (к.ч. = 12)
кубическая объемноцентрированная (к.ч. = 8)
Электропроводность (Ag – Hg)
Отражение света и радиоволн (Ag)
Ковкость пластичность (Au, Cu )
Твердость (твердые (Cr), мягкость (Cs)
Плотность (легкие с ρ < 5 г/см3, Be, Mg, Аl, Тi,)
тяжелые с ρ > 5 г/см3, W, Os
7. Плавкость (тугоплавкие с tпл> 1500° С с W, Mo, Nb, Ta легкоплавкие с tпл < 1000° С c S-металлы)
5. Химические свойства.
Все металлы – восстановители: M° – nē → Mn+ Отношение к агрессивным средам (окислителям) определя-
ется:
φ°, B – станд.электр.лотенциалом
«J», кДж/моль энергией ионизации
Наличием на поверхности металла защитной оксидной пленки
Агрессивные среды
1. Неметаллы – Э (галогены, кислород)
Mo – nē + Эо → Мn+ + Эn-
Вода (М с φ° < 0)
+ n НОН = Me(OH ) n + n/2(H2)
Кислоты
• кислоты не окислители (Мe, φ° <0)
HCl, H2SO4 разб.
М° + НА → МА + n/2(H2)
n + → min C.O.
• к-ты окислители (все М)
HNO3, H2SO4 конц.
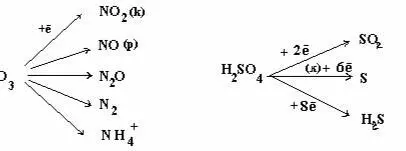
M со С.О. ≥ 4 с HNO3 образуют свои кислоты С.О. мах)
3Rе + 7HNO3 = 3HReO4 + 7NO + 2H2O
царская водка:
3 об. HCl конц. + I об. HNO3 конц.
А + 3НСl + HNO3 = АuСl3 + NO + 2H2O HCl + AuCl3 = H[AuCl4]
(Пассивирование металлов – HNO3, H2SO4 к)
4. Щелочи (для амфотерных металлов)
M + H2O + KOH – KX [M(OH )У ] + n/2(H2)
Cоединения металлов
хим. активны
неактивны
твердые, тугоплавкие
карбиды
электропроводны
ацетилениды
WC, W2C, TaB
CaC2+2H2O=Ca(OH)2+C2H2
не действуют даже
метаниды
сильные окислители
Be2C+4HCl=2BeCl2+CH4
коррзионностойкие
Кислотно-основные свойства кислородных соединений
с ростом С.О. основные
амфотерные
кислотные
СrO
Cr2O3
C2O3
Cr(OH)2
Cr(OH)3
H2CrO4
Окислительно-восстановительные свойства соединений
соединения со С.О мин.
– восстановители
со С.О макс.
– окислители
Mn+2
со С.О. пром. – и восстановители и окислители
– восстановитель
Mn+7
– окислитель
Mn+4
– восстановитель и окислитель
ПЛАСТИКИ И ПОЛИМЕРЫ
Простые элемент – ИДЫ)
М+Э – Мn+ + Эn-(«ЭО»)
Гидриды (Н-) Галиды (Г-) Оксиды (О-2) Нитриды (N-3) Карбиды (С– 4) Бориды (В-3)
Комплексные
4FeCl3+3K4[Fe(CN)4]=Fe4 [Fe(CN)6]3 + 12KCl
3FeCl2+2K3[Fe(CN)6]=Fe3[Fe(CN)6]2+6KCl
Природные полимеры распространены достаточно широко, это, например, белки и целлюлозы. Полимеры представляют собой соединения с длинными молекулами, построенными как последовательность повторяющихся идентичных химических единиц, связанных в цепи ковалентными связями. Возможно, основные сведения о способах синтеза полимеров химии приобрели, пытаясь получить синтетический аналог натурального каучука» Сегодня химики создали так много полимеров столь разнообразного целевого назначения, что уже трудно пред-ставить себе современное общество лишенным возможности
Ионные
Ковалентные
Интерметаллиды
(Δ«ЭО» – max)
( «ЭО» – min)
(d-металлы)
(S – металлы,
(р-металлы)
донорно-акцепторная
хим.св.-ионная
ковалентная
со структурой
кристал.
атомная
внедрения
Реш.– ионная)
Читать дальшеИнтервал:
Закладка:










