Михаил Бармин - Общая и Неорганическая химия с примерами решения задач
- Название:Общая и Неорганическая химия с примерами решения задач
- Автор:
- Жанр:
- Издательство:Литагент Selfpub.ru (искл)
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Бармин - Общая и Неорганическая химия с примерами решения задач краткое содержание
Общая и Неорганическая химия с примерами решения задач - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Совокупность иона металла и окружающих его лигандов названа Вернером внутренней сферой комплекса. Ее обычно заключают в квадратные скобки. Все остальное в КС составляет внешнюю сферу и пишется за квадратными скобками.
Первой задачей на пути исследования строения КС – является установление состава внутренней сферы. СoCl3 • 6NH3. Центральный атом – ион кобальта (III). Действительно, при
действии щелочи на раствор комплекса не происходит образо-вания Со(ОН)3.
Нейтральные лиганды, как правило, входят во внутреннюю сферу комплекса. Можно убедиться (фенолфталеин), что свободного NH3 в растворе нет. Хлорид ионы осаждаются ионами серебра в виде AgCl. По массе осадка можно убедиться, что все ионы Cl– переходят в AgCl.
Таким образом [Co(NH3) 6] 3+ осаждение Cl– показало, что все три хлорид-иона во внешней сфере.
Следовательно [Co(NH3) 6] Cl3 в целом нейтрально. Положительный заряд комплексного иона компенсировал отрицательный заряд трех хлорид-ионов.
После количественного осаждения ионов Cl– нитратом серебра и отделения осадка и выпаривания раствора выделится КС.
Таким образом, произошло замещение Cl– на NO3
[Co (NH3) 6]Cl3 + 3AgNO3 = [Co(NH3) 6](NO3) 3 + 3AgCl
Вернер будучи хорошо знаком с трудами Ле Беля и Вант-Гоффа – основоположников учения о стереохимии и сам внес в него значительный вклад.
Он предположил, что КС с координационным числом 6 имеют конфигурацию октаэдра, в центре которого находится ион металла а лиганды в его вершинах.
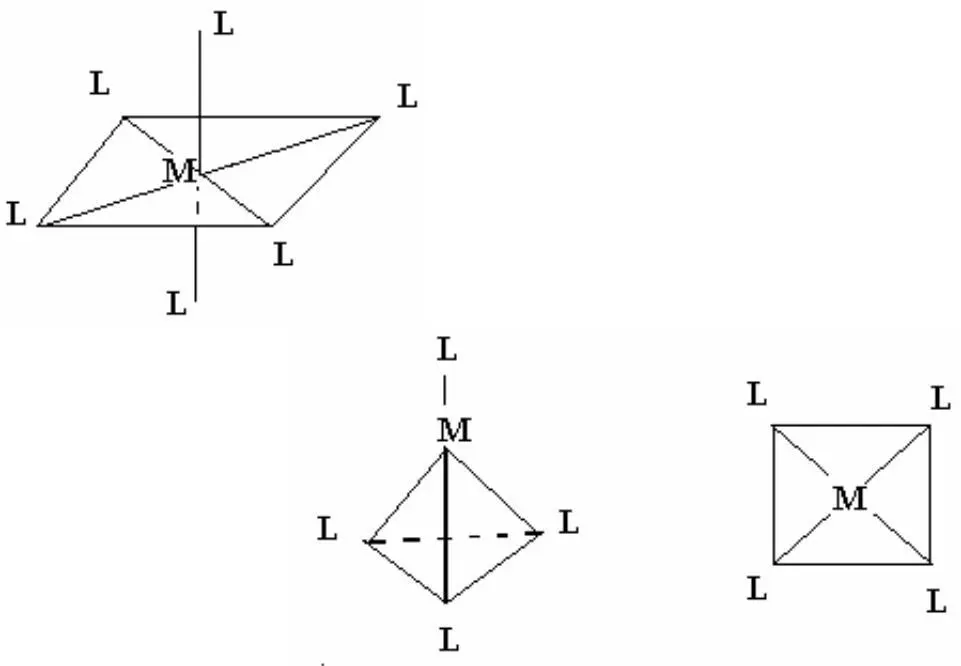
КС с координационным числом 4 – тетраэдрическое или плоскоквад-ратное строение
Для комплексов состава CoCl3 • 4NH3 лиганды могут
быть расположены по двум вариантам:
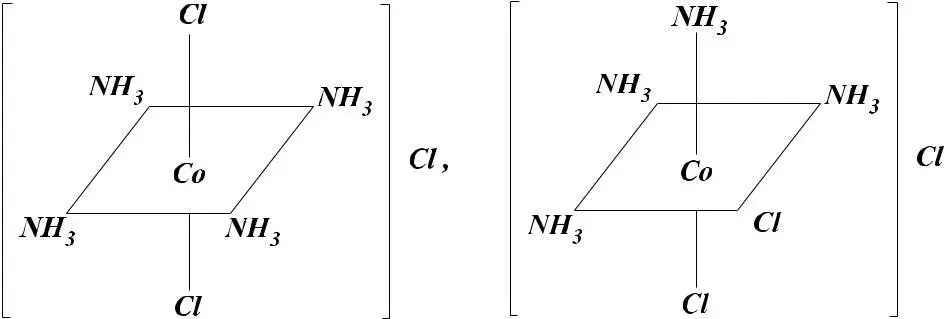
Октаэдрическая конфигурация допускает существование
двух изомерных форм.
Для комплексов состава PtCl2 • 2NH3 получены две изомерные ормы. Тетраэдрическое строение этих комплексов не должно приводить к соединениям с различным строением. Как не переставляй лиганды Cl– и NH3 вокруг центрального иона, получите лишь один вариант строения. Если же комплексы состава PtCl2 • 2NH3 построены по типу квадрата, то возможны два варианта:
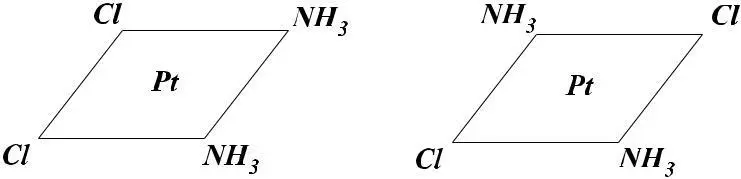
Поскольку изомерные формы были известны, то Вернер при-писал комплексам платины (П) строение плоского квадрата.
4. Одной из трудностей, возникших на пути признания координационной теории, было ее разногласие с существовавшей теорией валентности. Рамки теории валентности оказались узкими для К.С. Действительно, если соединение PtCl2 соответс-
твовало теории валентности, то строение его комплексного производного PtCl2•2KCl, т.е. K 2[PtCl4], не могло быть объяснено
с тех же позиций. Ион Pt (П) в этом комплексном соединении связан с четырьмя кислотными остатками. Существовавшая теория валентности допускала образование между ними и ионами Cl– только двух химических связей. Вернеру пришлось ввести понятия главной и побочной валентности. В простых соединениях атомы связаны главными валентностями. После их насыщения центральный атом способен присоединять дополнительные атомы или молекулы за счет побочных валентностей.
Относительно природы главных и побочных валентностей Вернер предпочитал не высказываться.
После создания координационной теории стало ясно,
что классические представления о валентности слишком узки. Например, валентность железа в Fe(CN)3 равна трем, а
в [Fe(CN ) 6]3– – шести. По существу валентность стали отожрестало играть для химии столь важную роль. Вместо понятия валентности химики стали все чаще пользоваться координационным числом в совокупности со степенью окисления.
Образование многих К.С. можно в первом приближении объяснить электростатическим притяжением между центральным катионом металла и анионами или полярными молекулами ли-гандов.
Наряду с силами притяжения действуют и силы электростатического отталкивания одноименно заряженными (одинаково ориентированными) лигандами. В результате образуется наиболее устойчивая группировка атомов (ионов), обладающая минимальной потенциальной энергией.
Количественные расчеты на основе такой электростатической модели впервые были выполнены В.Косселем и А.Магнусом, ко-торые принимали ионы за недеформируемые шары и учитывали их взаимодействие по закону Кулона. Результаты этих расчетов удовлетворительно передают зависимость координационного числа от заряда центрального иона. Однако электростатическая теория не в состоянии объяснить избирательность (специфичность) комплексообразования, поскольку она не принимает во внимание природу центрального атома и лигандов, особенности строения их электронных оболочек. Для учета этих особенностей теория была дополнена поляризационными представлениями, согласно которым комплексообразованию благоприятствует участие в качестве центральных атомов небольших многозарядных катионов d-элементов, обладающих сильным поляризующим действием, а в качестве лигандов – больших, легко поляризующихся ионов или молекул. В этом случае происходит деформация электронных оболочек центрального атома и лигандов, приводящая к их взаимопроникновению, что и вызывает упрочнение связей.
5. На первых порах развитие координационной химии ученым было легче оперировать константами неустойчивости К.С., так как они по форме и смыслу напоминали константы диссоциации слабых многоосновных кислот. Например, первая ступень диссоциации комплексного иона
[HgJ4]2– < == > [HgJ4]– + [J-]
дествлять с координационным числом. С этой точки зрения валентности в вышеназванных соединениях одинаковы. Такое расширение понятия валентности привело к тому, что оно пе-
и Кнест:
Kнест = [HgJ4]– [J ]-

[HgJ4]2-
аналогична H3PO4 < == > H2PO4– + H+
Kд = [H2PO4]– [H+]

[H3PO4]
Поэтому расчет концентраций отдельных комплексных форм проводили так же, как расчет концентраций ионов многоосновных кислот. Далее оказалось удобнее использовать константу устойчивости, которая является обратной величиной Ку = 1/Кн.
6. Реагенты (α-нитрозо– β-нафтол (1) и 8-оксихинолин (II) начали применять в качестве аналитических реагентов еще до создания координационной теории.
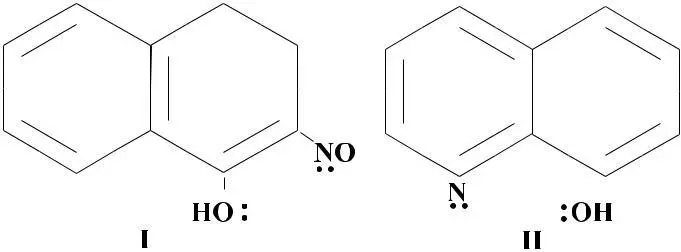
Видно, что координируясь посредством электронных пар, отмеченных в формулах, эти реагенты способны замыкать около иона металла 5-членные циклы. Широкое использование этих и других органических реагентов для определения ионов металлов началось после эффектного использования Чугаевым диметилглиоксима в качестве реагента на ион никеля. Красивый яркий малиновый цвет осадка при полнейшей безвредности для организма человека использован парфюмерами для изготовления губной помады.
Читать дальшеИнтервал:
Закладка:










