Михаил Бармин - Общая и Неорганическая химия с примерами решения задач
- Название:Общая и Неорганическая химия с примерами решения задач
- Автор:
- Жанр:
- Издательство:Литагент Selfpub.ru (искл)
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Бармин - Общая и Неорганическая химия с примерами решения задач краткое содержание
Общая и Неорганическая химия с примерами решения задач - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
среде электролита (морская вода, подземные, почвенные воды и т.д.). Сущность такой защиты заключается в том, что конструкцию соединяют с протектором – более активным металлом, чем металл защищаемой конструкции. В качестве протектора при защите стальных изделий обычно используют магний, алюминий, цинк и их сплавы. В процессе коррозии
протектор служит анодом и разрушается, тем самым предохраняя от разрушения конструкцию. По мере разрушения протекторов их заменяют новыми.
На этом принципе основана и электрозащита. Конструкция, находящаяся в среде электролита, также соединяется с другим металлом (обычно куском железа, рельсом и т.п.), но через внешний источник тока. При этом защищаемую конструкцию присоединяют к катоду, а металл – к аноду источника тока.
Электроны отнимаются от анода источником тока, анод (защищающий металл) разрушается, а на катоде происходит восстановление окислителя.
Электрозащита имеет преимущество перед протекторной защитой: радиус действия первой около 2000 м, второй – около 50 м.
Изменение состава среды. Для замедления коррозии металлических изделий в электролит вводят вещества (чаще всего органические), называемые замедлителями коррозии, или ингибиторами. Они применяются в тех случаях, когда металл следует защищать от разъедания кислотами. Советские ученые создали ряд ингибиторов (препараты марок ЧМ, ПБ и др.), которые, будучи добавлены к кислоте, в сотни раз замедляют рас-творение (коррозию) металлов.
В последние годы разработаны летучие (или атмосферные) ингибиторы. Ими пропитывают бумагу, которой обертывают металлические изделия. Пары ингибиторов адсорбируются на поверхности металла и образуют на ней защитную пленку.
Ингибиторы широко применяются при химической очистке от накипи паровых котлов, снятии окалины с обработанных изделий, а также при хранении и перевозке соляной кислоты в стальной таре. К числу неорганических ингибиторов относятся нитриты, хроматы, фосфаты, силикаты. Механизм действия ингибиторов является предметом исследования многих химиков.
Девиз : «ВЕЩЬ В СЕБЕ»
ЛЕКЦИЯ 13
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
План:
Термин комплексные соединения (КС) и история их открытия.
Основные положения координационной теории Альфреда Вернера.
Пространственное строение и изомерия КС.
Природа химической связи
Диссоциация в растворах. Константа нестойкости (КНЕСТ).
Где и для чего их применяют.
1. Соединение высшего порядка – так называл знаменитый шведский химик И.Я.Берцелиус (1779-1848) сложные многокомпонентные химические соединения, строение которых очень долго оставалась загадкой для ученых. Данный термин широко использовал А.Вернер и многие другие ученые конца XIX и начала XX века. Теперь эти соединения называют комплексными, но чаще – координационными. Термин “комплексные соединения” введен в химическую литературу выдающимся физико-химиком В.Оствальдом. Координационными их стали называть после того, как в умах ученых утвердилась координационная теория А.Вернера описывающая строение данных соединений.
Почему высшего порядка? Бросается в глаза, что эти сложные (комплексные) соединения можно рассматривать как состоящие из простых, способных к самостоятельному существованию. Например, при растворении AgCl в водном растворе аммиака получается соединение [Ag(NH3)2]Cl (хлорид диамин серебра (1), формулу которого можно записать AgCl • 2NH3 Действительно, это сложное соединение состоит из простого, давно известного AgCl и также хорошо известного NH3. Конечно же, и то и другое способно к самостоятельному существованию. Однако, в К.С. AgCl и NH3 кардинально изменяют свои свойства.
Время рождения координационной химии как науки связы-вают со случайным получением в 1798 году Тассером соединения CoCl3 • 6NH3. Между тем были известны соединения высшего по-рядка и до открытия Тассера. Вероятно, первым подобным соединением, синтезированным в лаборатории, является берлинская лазурь Fe4[Fe(CN)6]3. Она случайно получена художником Дисбахом в 1704г. Ииспользована как красящий пигмент.
На несколько миллиардов лет раньше, природа создала такие соединения высшего порядка как FeSO4 • 7H2O и СuSO4 • 5H2O
(железистый и медный купороc). Первое встречается в виде минерала механтерита, второй в виде халькантита. Человеку они стали известны уже в XIII веке.
Из берлинской лазури и едкого калия Макер в 1749 году впервые получил желтую кровяную соль K4(Fe(CN)6).
Итак, соединения высшего порядка были известны и до Тассера. Однако, только после получения CoCl3 • 6NH3 химики осознали, что имеются соединения, не вписывающиеся ни в какие привычные категории (Петух не делает утра, но он будит).
В становлении и развитии химии К.С. большой вклад был внесен шведскими и датскими химиками Берцелиусом, Бломстрандом, Клеве, Иергенсен. В конце XIX века, центром по изучению химии К.С. стал Цюрих, где работал создатель координационной теории Альфред Вернер. После его кончины важные исследования были выполнены в Германии его учеником Паулем Пфейфером. В начале текущего столетия наибольший прогресс в этой области химии достигнут в нашей стране благодаря Льву Александровичу Чугаеву, который создал уникальную со-ветскую школу химиков-комплексников. Следует отметить, что еще в конце XIX столетия яркий цикл исследований по химии комплексных соединений выполнен в России Николаем Семеновичем Курнаковым. Огромный вклад в химию К.С. внесли Чатт в Великобритании, Дж.Бейлар в США, Л.Силлен в Швеции
многие другие ученые в различных странах.
Теоретические представления о К.С. развивались на основе прочных комплексов довольно узкого круга металлов: КОБАЛЬТА (III), ПЛАТИНЫ (II), ПЛАТИНЫ (IV), ХРОМА (II), МЕДИ(П). Синтез проводился из их солей, а в качестве другой составляющей широко использовался аммиак.
Одной из важнейших вех на пути к координационной теории были аммонийная гипотеза английского ученого Т.Грэма (1840г.). Он усматривал аналогию между взаимодействием ам-
миака с кислотами и с солями металлов.
NH3 + HCl → {H+NH3}Cl
2NH3 + CuCl2 → {Cu2+(NH3)2}Cl2
Эту догадку можно отнести к числу гениальных прозрений. Трудности у Грэма возникали в связи с тем, что число молекул аммиака, присоединившихся к металлу, например в CoCl3 • 6NH3, часто было больше, чем число эквивалентов металла или, говоря современным языком, число присоединившихся молекул аммиака часто превышало степень окисления иона металла (III и 6).
В середине ХIХ века комплексообразование иногда трактовалось как переход III азота в V азот по уравнению:
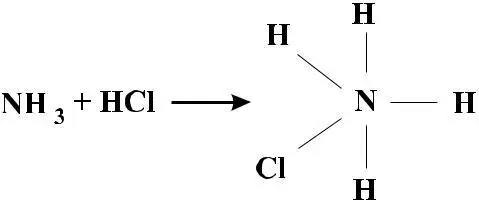
Грем полагал, что вместо одного из атомов водорода в аммо-нийном ионе находится металл:
Читать дальшеИнтервал:
Закладка:










