Михаил Бармин - Общая и Неорганическая химия с примерами решения задач
- Название:Общая и Неорганическая химия с примерами решения задач
- Автор:
- Жанр:
- Издательство:Литагент Selfpub.ru (искл)
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Бармин - Общая и Неорганическая химия с примерами решения задач краткое содержание
Общая и Неорганическая химия с примерами решения задач - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Примером химической коррозии в неэлектролитах может служить разрушение цилиндров двигателей внутреннего сго-рания. В топливе содержатся примеси – сера и ее соединения, которые при сгорании превращаются в оксиды серы (IV) и (VI) – коррозионно-активные вещества. Они разрушают детали реактивных двигателей – сопла и др. Наибольший вред приносит электрохимическая коррозия.
Электрохимической коррозией называется разрушение металла в среде электролита с возникновением внутри системы электрического тока.
этом случае наряду с химическими процессами (отдача электронов) протекают и электрические (перенос электронов от одного участка к другому).
качестве примера электрохимической коррозии можно привести коррозию железа в контакте с медью в растворе электролита соляной кислоты (т.е. при высокой концентрации ио-нов водорода Н+). При таком контакте возникает гальванический элемент.
Как показано на рисунке более активный металл – железо (анод) окисляется, посылая электроны атомам меди, и переходит в раствор в виде ионов Fe2+, образуя с хлорид-ионами среды хлорид железа(II) FeCl2.
Ионы же водорода движутся к меди (катоду), где, принимая электроны, разряжаются.
ионной форме эти реакции могут быть выражены суммарным уравнением:
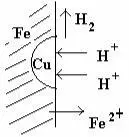
Fе0 – – 2ē = Fе2+
2Н+ + 2ē =H2.
–
Fe + 2H+ = Fе2+ + H2.↑
или
Fe + 2HCl = FeCl2 + H2↓↓
или
На катодах вместо разряда ионов водорода (или молекул воды) может протекать процесс восстановления кислорода, растворенного в электролите:
O2 + 2H2O + 4ē = 4OH-,
т.е. связывание электронов на поверхности катода осуществляется молекулами кислорода. Это так называемая кислородная деполяризация катода. Какой процесс будет протекать, зависит от условий: в кислой среде выделяется водород (происходит водородная деполяризация катода: 2Н + + 2ē =H2.), в нейтральной и щелочной средах (при коррозии стали, железа) происходит кислородная деполяризация катода и водород не выделяется. В этом случае образовавшееся гидроксидионы ОН-
соединяются с перешедшими в раствор ионами Fe2+:
Fe2+ + 2OH– = Fe(OH)2
Гидроксид железа (II) в присутствии воды и кислорода воздуха переходит в гидроксид железа (III):
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
Гидроксид железа (III) можно представить как
2Fe2O3• nH2O
Электрохимическую коррозию вызывают главным образом примеси других металлов и неметаллических веществ или неоднородность поверхности. Согласно теории электрохимической коррозии в этих случаях при соприкосновении металла с электролитом (электролитом может быть влага, адсорбируемая из воздуха) на его поверхности возникают гальванические микроэлементы. При этом металл с более отрицательным потенци-алом разрушается – ионы его переходят в раствор, а электроны переходят к менее активному металлу, на котором происходит восстановление ионов водорода (водородная деполяризация) или восстановление растворенного в воде кислорода (кислородная деполяризация).
Таким образом, при электрохимической коррозии (как в случае контакта разнородных металлов, так и в случае образования микрогальванических элементов на поверхности одного металла) поток электронов направлен от более активного металла к менее активному (проводнику), и более активный металл корродирует.
Скорость коррозии тем больше, чем дальше расположены друг от друга в ряду стандартных электродных потенциалов те металлы, из которых образовался гальванический элемент (гальваническая пара).
На скорость коррозии влияет и характер раствора электролита. Чем выше его кислотность (т.е. меньше pH), а также чем больше содержание в нем окислителей, тем быстрее протекает коррозия. Значительно возрастает коррозия с ростом температуры.
Некоторые металлы при соприкосновении с кислородом воздуха или в агрессивной среде переходят в пассивное состояние, при котором резко замедляется коррозия. Например, концентрированная азотная кислота легко делает пассивным железо, и оно практически не реагирует с концентрированной азотной кислотой. В таких случаях на поверхности металла образуется плотная защитная оксидная пленка, которая препятствует контакту металла со средой.
Защитная планка всегда имеется на поверхности алюминия. Подобные пленки в сухом воздухе образуются также на Be, Cr, Zn, Ta, Ni, Cu и других металлах. Кислород является наиболее распространенным пассиватором.
Пассивированием объясняется коррозионная стойкость нержавеющих сталей и сплавов.
Защита от коррозии
Коррозия металлов протекает непрерывно и причиняет огромные убытки. Подсчитано, что прямые потери железа от коррозии составляют около 10 % его ежегодной выплавки. В результате коррозии металлические изделия теряют свои ценные технические свойства. Поэтому имеют очень большое значение методы защиты металлов и сплавов от коррозии. Они весьма разнообразны. Назовем некоторые из них.
Защитные поверхностные покрытия металлов
Они бывают металлическими (покрытие цинком, оловом,
свинцом, никелем, хромом,
и другими металлами) и неметаллическими (покрытие лаком, краской, эмалью и
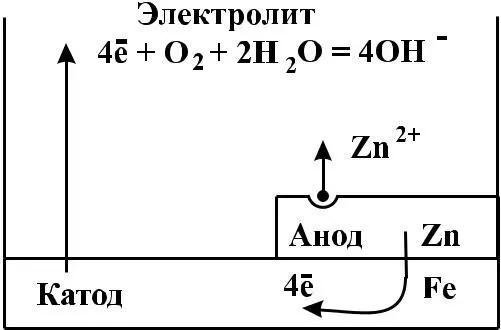
другими веществами). Эти покрытия изолируют металл от внешней среды. Так, кровельное железо покрывают цинком: из оцинкованного железа изготавливают многие изделия бытового и промышленного значения. Слой цинка предохраняет железо от коррозии, так как хотя цинк и является более активным металлом, чем железо (см. ряд стандартных электродных потенциалов металлов), он покрыт оксидной пленкой. При повреждениях защитного слоя (царапины, пробои крыш и т.д.)
присутствии влаги возникает гальваническая пара Zn/Fe. Катодом (положительным полюсом) является железо, анодом (отрицательная полюсом) – цинк. Электроны переходят от цинка к железу, где связываются молекулами кислорода (кислородная деполяризация), цинк растворяется, но железо остается защищенным до тех пор, пока не разрушится весь слой цинка, на что требуется довольно много времени. Покрытие железных изделий никелем, хромом, помимо защиты от коррозии, придает им красивый внешний вид.
Создание сплавов с аникоррозионными свойствами. Введе
нием в состав стали до 12 % хрома получают нержавеющую сталь, устойчивую к коррозии. Добавки никеля, кобальта и меди усиливают антикоррозионные свойства стали, как повышает склонность сплавов к пассивации. Создание сплавов с антикоррозионными свойствами – одно из важных направлений борьбы с коррозионными потерями.
Протекторная защита и электрозащита. Протекторная за-
щита применяется в тех случаях, когда защищается конструкция (подземный трубопровод, корпус судна), находящаяся
Читать дальшеИнтервал:
Закладка:










