Александр Артеменко - Удивительный мир органической химии
- Название:Удивительный мир органической химии
- Автор:
- Жанр:
- Издательство:Дрофа
- Год:2005
- Город:Москва
- ISBN:5-7107-9540-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Артеменко - Удивительный мир органической химии краткое содержание
Книга адресована старшеклассникам, учителям, а также тем, кто интересуется органической химией.
Удивительный мир органической химии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Кроме реакций галогенирования (хлорирования, бромирования), алканы в особых условиях могут вступать во взаимодействие с кислотами — азотной и серной. Например, при действии разбавленной азотной кислоты (при нагревании и давлении) происходит замещение водородных атомов в алканах на группу NO 2(нитрогруппу):
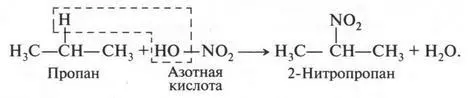
Такие реакции называют реакциями нитрования. Впервые реакцию нитрования провел в 1888 г. Михаил Иванович Коновалов (1858-1906). Поэтому такая реакция носит имя этого русского химика.

Продукты, образованные в результате реакции нитрования, называются нитросоединениями.
Если на алкан действовать смесью оксида серы (IV) и хлора, то получают продукт, который называется сульфохлоридом. Например:

Такие реакции называются реакциями сульфохлорирования. Первую реакцию сульфохлорирования провели в США в 1936 г. Реакции сульфохлорирования приводят к получению очень важных органических продуктов — сульфокислот. Для этого на сульфохлорид нужно подействовать водой. В результате получают два продукта — сульфокислоту и соляную кислоту:
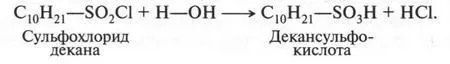
Таким образом, сульфокислота — это продукт замещения атома водорода в алканах на сульфогруппу (—SO 3H). Можно ли получать сульфокислоты, непосредственно воздействуя серной кислотой на алканы? Да, иногда это удается, если алканы содержат значительное количество углеродных атомов. Низшие же алканы с серной кислотой при обычных условиях не взаимодействуют, а при нагревании происходит их окисление.
Реакции нитрования и сульфохлорирования имеют также цепной радикальный характер.
Таким образом, из алканов можно получать различные органические вещества. Изучению алканов и их химическим превращениям посвятил свою жизнь известный немецкий химик Карл Шорлеммер (1834-1892). Кстати, он назвал органическую химию химией углеводородов и их производных. А ведь алканы — это углеводороды: их молекулы состоят из атомов углерода и водорода. Таким образом, два определения органической химии — А. М. Бутлерова и К. Шорлеммера — не противоречат, а дополняют друг друга.
Алканы — горючие вещества. При горении метана выделяется большое количество энергии (880 кДж/моль):

Наряду с метаном в качестве топлива часто используют смесь пропана (С 3Н 8) и бутана (С 4Н 10). Эту смесь называют бытовым сжиженным газом. Его перевозят в баллонах (красного цвета) и применяют там, где нет природного газа.
При обычных условиях алканы устойчивы к действию даже сильных окислителей. Но при использовании катализаторов и одновременном нагревании алканы окисляются с образованием многих ценных продуктов (спиртов, карбоновых кислот и др.).
В одном из разделов этой книги мы познакомимся с различными видами топлива, в основе которых — те же самые алканы.
3.2. Всегда ли двойная связь прочнее?
Житейский опыт подсказывает, что двойная связь прочнее. Действительно, если морское судно привязано к пирсу двумя канатами, то это надежнее, чем если оно прикреплено одним. Но, оказывается, это не всегда так. Дело в том, что наши представления о прочности связей в бытовом плане неприменимы к другим связям — химическим. Поэтому двойная и даже тройная связь между углеродными атомами в органических молекулах вовсе не делает эту связь более прочной. Более того, такая связь будет менее прочной, чем одинарная. Но чтобы это понять, поговорим о самом простом органическом веществе, в молекуле которого углеродные атомы связаны двойной связью. Это — этилен. Этилен — бесцветный газ со сладковатым запахом, является составной частью природного или попутного газов (правда, в природном газе содержание этилена невелико — 0,5-4%).
Впервые этилен был получен в 1669 г. немецким химиком Иоганном Иоахимом Бехером (1635-1682). Однако изучение этого газа началось приблизительно через сто лет после его открытия. Все это время этилен был известен под названием «воздух Бехера». В 1795 г. голландские химики во главе с Иоганном Рудольфом Дейманом (1743-1808) подробно описали способ получения этого «воздуха» из этилового спирта и серной кислоты, а также его свойства. Они установили, что «воздух Бехера» состоит из углерода и водорода, легко вступает в реакцию с хлором, образуя маслянистую жидкость, названную потом «маслом голландских химиков». Как оказалось, это был 1,2-дихлорэтан ClСН 2—СН 2Cl. Позже «воздух Бехера» назвали олефиновым газом (т. е. маслородным). Кстати, олефинами стали называть и другие углеводороды, которые своими свойствами напоминали олефиновый газ, а последнему дали название — этилен. Под таким названием мы его и знаем.
Если метан — «родоначальник» алканов, то этилен дает начало другим углеводородам — этиленовым (алкенам ). Эти соединения также образуют свой гомологический ряд, который имеет общую формулу С nН 2n. Если ее сравнить с общей формулой для алканов (С nН 2n+2), нетрудно заметить разницу: молекулы алкенов содержат на два водородных атома меньше. Поскольку молекула этилена содержит два атома углерода и четыре атома водорода, то его эмпирическая формула будет С 2Н 4. Однако эта формула не дает представления о строении этилена. Поэтому попытаемся изобразить возможные структуры для формулы С 2Н 4.
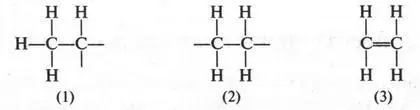
Придется сразу отказаться от структур (1) и (2), как нереальных. Действительно, они имеют по две свободные валентности, а это означает, что такие соединения будут крайне неустойчивыми. А ведь этилен — вещество вполне устойчивое и способно существовать сколько угодно времени. Таким образом, остается структура (3) с двойной связью между углеродными атомами. Как оказалось впоследствии, именно эта структура и выражает строение молекулы этилена. Итак, этилен — соединение с двойной связью между углеродными атомами.
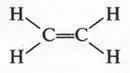
Две черточки между углеродными атомами означают, что связь образовалась в результате обобществления двух пар электронов, т. е. двойную связь можно представить так:
Читать дальшеИнтервал:
Закладка:









