Александр Артеменко - Удивительный мир органической химии
- Название:Удивительный мир органической химии
- Автор:
- Жанр:
- Издательство:Дрофа
- Год:2005
- Город:Москва
- ISBN:5-7107-9540-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Артеменко - Удивительный мир органической химии краткое содержание
Книга адресована старшеклассникам, учителям, а также тем, кто интересуется органической химией.
Удивительный мир органической химии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
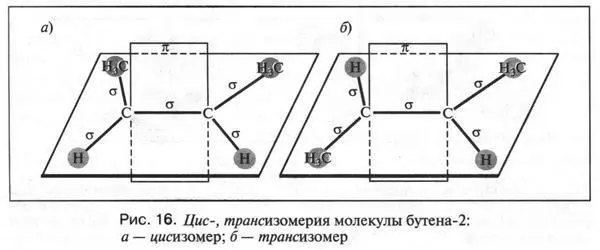
Цис-, транс изомеры, имея различное пространственное строение, отличаются физическими, химическими, а иногда даже — физиологическими свойствами.
Как получают этилен? Обычно его выделяют из газов нефтепереработки, а также из газов коксования угля. Но можно получать этилен и в лаборатории. Еще в 1860 г., исследуя взаимодействие йодистого метилена с галогеноотнимающими средствами, А. М. Бутлеров не только получил этилен, но и сделал вывод о том, что в его молекуле должна быть двойная связь! Эта реакция протекала так:
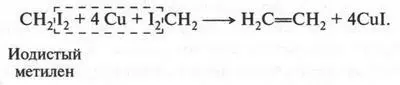
Отщепляя воду от этилового спирта, тоже можно получить этилен. Для этого спирт нагревают с концентрированной серной кислотой:
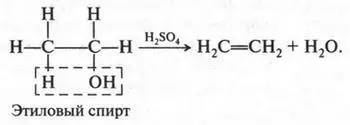
Если же вместо этилового спирта использовать пропиловый спирт, то получим второй представитель алкенов — пропилен (пропен):
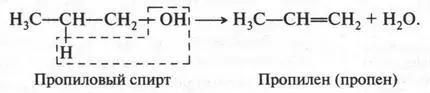
Пропилен во многом напоминает этилен. Он легко вступает в реакции присоединения. При присоединении водорода (в присутствии катализатора) он превращается в пропан, а при воздействии галогенов — в галогенопроизводные:
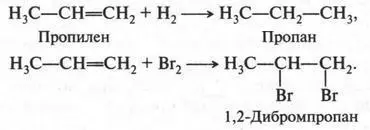
Галогеноводороды также присоединяются к пропилену. Но в отличие от этилена в этом случае может получиться два продукта.
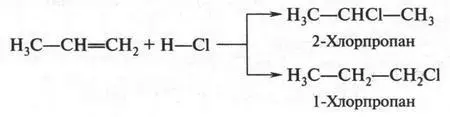
Посмотрите внимательно на их формулы. Нетрудно заметить, что атомы хлора и водорода по-разному присоединились к углеродным атомам. Эту реакцию еще в XIX в. изучал Владимир Владимирович Марковников (1838-1904).  Он установил (1869) правило, которое носит его имя: атом водорода в этой реакции присоединяется к углеродному атому, с которым связано больше атомов водорода, а атом галогена — к атому углерода, у которого водородных атомов меньше. Следовательно, из двух продуктов наиболее вероятным будет 2-хлорпропан. Как сейчас химики объясняют это правило?
Он установил (1869) правило, которое носит его имя: атом водорода в этой реакции присоединяется к углеродному атому, с которым связано больше атомов водорода, а атом галогена — к атому углерода, у которого водородных атомов меньше. Следовательно, из двух продуктов наиболее вероятным будет 2-хлорпропан. Как сейчас химики объясняют это правило?
Молекула пропилена, в отличие от молекулы этилена, несимметрична. Поэтому в ней электронная плотность распределена неравномерно. Дело в том, что электронная плотность в молекуле смещена от метильной группы в сторону двойной связи:
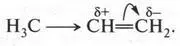
Направление распределения электронов показано стрелками. На крайнем углеродном атоме, который связан двойной связью, образуется небольшой (частичный) отрицательный заряд, обозначаемый δ -(дельта минус). На втором же атоме углерода создается недостаток электронов (возникает частичный положительный заряд δ +). Теперь нетрудно догадаться, что положительно заряженный атом водорода (протон) свяжется с крайним углеродным атомом (он несет избыток электронной плотности), а атом галогена устремится туда, где атом углерода имеет частичный положительный заряд.
Этиленовые углеводороды обладают еще одним интересным свойством. Они вступают в реакцию полимеризации, в результате которой образуется полимерный продукт. Например, при полимеризации этилена химики синтезируют замечательный продукт — полиэтилен:
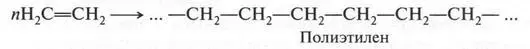
О таких реакциях мы поговорим позже, когда познакомимся с высокомолекулярными соединениями.
Этиленовые углеводороды горят с выделением энергии. Вот как можно записать реакцию горения этилена:
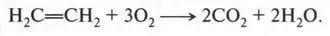
С воздухом этилен, как и метан, образует взрывоопасные смеси.
В заключение скажем, что этилен и его гомологи — источники большого числа разнообразных органических соединений. Например, этилен используют для получения полиэтилена, этилового спирта, галогенопроизводных, оксида этилена и многих других ценных продуктов.
3.3. Всем известный ацетилен
Углеродные атомы могут соединяться между собой не только с помощью двойной связи, но и тройной. Самым простым углеводородом, содержащим тройную связь, является известный многим газ — ацетилен. Этот газ бесцветен, не имеет запаха. Однако при его получении из карбида кальция (а именно так получают ацетилен в технике) образуются газообразные примеси (РН 3, H 2S, NH 3), которые придают ацетилену типичный «карбидный запах». Наверное, многие его ощущали в тех местах, где занимаются сваркой или резкой металлов. Ацетилен при горении в кислороде создает высокотемпературное пламя (свыше 3000 °С). Это и используют в технике. Кстати, ацетилен для автогенной сварки начали использовать еще в 1906 г. в США. Смеси ацетилена с кислородом или воздухом взрывоопасны, поэтому ацетилен хранят и транспортируют в специальных баллонах.
Впервые об ацетилене узнали в 1836 г., когда он был получен при действии воды на карбид кальция (СаС 2). Но в 1862 г. этот газ уже был синтезирован М. Бертло при пропускании водорода через электрическую дугу между двумя угольными электродами (т. е. из элементов — углерода и водорода). Этот же ученый определил его состав (С 2Н 2) и дал этому газу название — ацетилен. Кроме того, он предположил, что ацетилен является первым углеводородом, образующим гомологический ряд с общей формулой С nН 2n-2.
Итак, молекула ацетилена состоит из двух атомов углерода и двух водородных атомов. Следовательно, чтобы соблюсти четырехвалентность атома углерода, формулу ацетилена следует записать так:
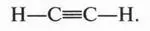
Ацетилен — самое простое органическое соединение с тройной связью между углеродными атомами. Как же устроена такая связь?
Для объяснения снова обратимся к теории гибридизации. Согласно этой теории атом углерода в молекуле ацетилена находится в состоянии sp -гибридизации. Перекрыванием двух sp -гибридных орбиталей (по одной от каждого углеродного атома) образуется одна связь между углеродными атомами. Это — σ-связь, которую в формулах обозначаем одной черточкой. Две другие sp -гибридные орбитали (также по одной от каждого углеродного атома) образуют с 1 s -орбиталями двух водородных атомов две σ-связи С—Н. Они расположены друг относительно друга под углом 180°. Но у каждого углеродного атома остались еще по две негибридизованные 2 р -орбитали! Вот они-то, перекрываясь в двух взаимно перпендикулярных плоскостях, и образуют две π-связи. В формуле они обозначены еще двумя черточками. Обратите внимание, что перекрывание 2 p -орбиталей, как в случае этилена, происходит «боками», а не «лбами». Поэтому прочность образовавшихся π-связей незначительна. Как видно из рисунка 17, молекула ацетилена имеет линейное строение. Таким образом, символ из трех черточек в формуле молекулы ацетилена означает сочетание одной σ-связи и двух π-связей.
Читать дальшеИнтервал:
Закладка:









