Александр Артеменко - Удивительный мир органической химии
- Название:Удивительный мир органической химии
- Автор:
- Жанр:
- Издательство:Дрофа
- Год:2005
- Город:Москва
- ISBN:5-7107-9540-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Артеменко - Удивительный мир органической химии краткое содержание
Книга адресована старшеклассникам, учителям, а также тем, кто интересуется органической химией.
Удивительный мир органической химии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
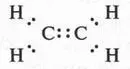
Следует сказать, что обозначение двойной связи при помощи двух черточек ввел немецкий химик Эмиль Эрленмейер (1825-1909).
Двойная связь в молекуле этилена — настоящая ахиллесова пята этого соединения. Это тот случай, когда двойная связь — «хуже», чем одинарная. Действительно, если алканы — довольно устойчивые соединения, вступающие в основном только в реакции замещения, то этилен и его гомологи — очень активные вещества, для которых характерны реакции присоединения. Например, если через водный раствор брома (бромная вода) пропустить этилен, то красновато-бурый цвет раствора исчезнет. Это означает, что произошла реакция. Химики установили, что в этом случае молекула брома присоединилась к этилену:
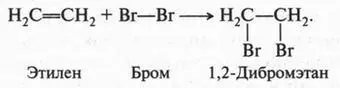
В полученном продукте (1,2-дибромэтан) отсутствует двойная связь между углеродными атомами. То же самое происходит, если к этилену присоединить молекулу хлора (помните «масло голландских химиков» — 1,2-дихлорэтан?). Если к этилену присоединить молекулу водорода (в присутствии катализатора — платины), то получим предельный углеводород — этан, который, как нам известно, двойной связи не содержит:
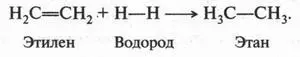
Этилен легко взаимодействует и с галогеноводородами, образуя галогенопроизводные:

Этилен присоединяет даже воду. Правда, это происходит только в присутствии серной кислоты:
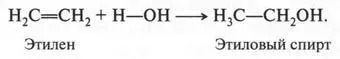
Вот так можно получить этиловый спирт.
Итак, в молекулах полученных веществ исчезла двойная связь! Это означает только одно: при реакциях присоединения происходит разрыв одной из связей между углеродными атомами и за счет освободившихся валентностей идет присоединение другой молекулы. Но это значит, что две связи, обозначаемые одинаковыми черточками, вовсе не одинаковы. Одна из них более прочная (она не разрывается), а вторая — более «ранимая» — разрывается:
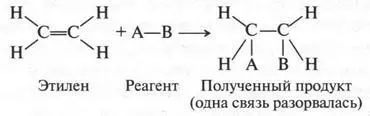
А вот теперь самый интересный вопрос: какая же связь сохранилась, а какая разорвалась? Если допустить, что двойная связь — сумма двух простых a-связей, то обе они не будут так легко разрываться при реакциях присоединения. Они будут вести себя так, как ведут обычные связи в алканах. Например, в молекуле этана. При этом добавим, что для них будут характерны реакции замещения, а не присоединения. Значит, двойная связь — это сумма разных по характеру связей. Но чтобы все это стало понятным, нам надо опять прибегнуть к теории гибридизации (видите, как она нас выручает!).
Давайте вспомним, что атом углерода в алкенах находится в состоянии sp 2-гибридизации. Это означает, что из четырех орбиталей атома углерода (одна 2 s и три 2 р) гибридизованы только три: одна 2 s- и две 2 р -орбитали. Эти орбитали, перекрываясь, образуют три обычные а-связи — одну С—С и две С—Н. Итак, одну С—С-связь мы установили. Это обычная σ-связь. А другая? Для этого продолжим наши рассуждения.
При гибридизации четвертая 2 p -орбиталь осталась неизмененной (в виде объемной восьмерки), т. е. негибридизованной. Она располагается в плоскости, которая перпендикулярна другой плоскости, в которой находятся три гибридизованные sp 2-орбитали. Поскольку в молекуле этилена два атома углерода, то все сказанное относится и ко второму углеродному атому. Эти две негибридизованные орбитали (по одной от каждого углеродного атома) при перекрывании друг с другом образуют новую химическую связь, которую химики называют π(пи)-связью. Отметим, что эта связь образована, как и обычная σ-связь, в результате обобществления электронов, но электронов «чистых», а не гибридизованных. Такие 2р- электроны называются π-электронами. При этом очень важно отметить, что перекрывание орбиталей этих электронов происходит не в «лобовых» областях, в которых электронная плотность гораздо выше, а в «боковых», в которых она меньше. Но это означает, что образованная π-связь будет менее прочной (чем полнее перекрывание орбиталей, тем прочнее связь). Вот почему при химических реакциях (при действии химических реагентов) π-связь будет легче разрываться.
Что же происходит с двумя другими гибридизованными орбиталями (всего-то их четыре, если учитывать два углеродных атома)? Они, перекрываясь с 1 s -орбиталями атомов водорода, образуют две одинаковые σ-связи С—Н. Как видно из рисунка 15, эти связи расположены в одной плоскости под углом 120° друг к другу.
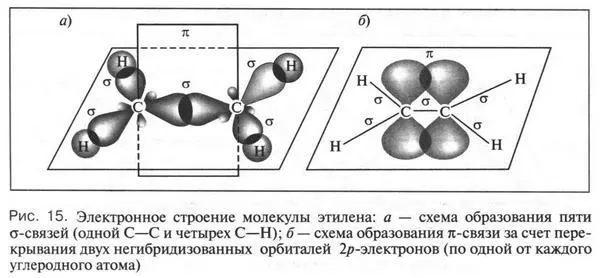
Сделаем важный вывод: символ из двух одинаковых черточек между углеродными атомами (двойная связь) в молекуле этилена означает комбинацию одной σ- и одной π-связи. Такое строение двойной связи находит подтверждение в особом виде изомерии, характерной только для этиленовых углеводородов. Эту изомерию назвали цис-, транс изомерией. Почему эта изомерия характерна только для этиленовых углеводородов?
Установлено, что вокруг простой a-связи возможно относительно свободное вращение атомов и атомных группировок. Но если углеродные атомы связаны двойной связью, то такое вращение невозможно. Этому мешает π-связь, которая образована перекрыванием двух негибридизованных 2 р -орбиталей. Если «поворачивать» одну группу СН 2относительно другой, то 2 р -орбитали будут выходить из состояния «внедрения» друг в друга. Но это означает, что π-связь разрушается! Чтобы этого не происходило, двойная связь (а точнее, π-связь) не допускает поворотов, т. е. атомы или группы атомов, которые связаны с углеродными атомами, строго фиксированы в пространстве. Поэтому, например, молекула бутилена (бутен-2) может находиться в виде двух пространственных изомеров.

Изомеры, в молекулах которых радикалы (в данном случае метальные группы) расположены по одну сторону от двойной связи, называются цис изомерами, а если по разные — транс изомерами (от лат. cis — по эту сторону, trans — через, т. е. по разные стороны) (рис. 16).
Читать дальшеИнтервал:
Закладка:









