Александр Артеменко - Удивительный мир органической химии
- Название:Удивительный мир органической химии
- Автор:
- Жанр:
- Издательство:Дрофа
- Год:2005
- Город:Москва
- ISBN:5-7107-9540-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Артеменко - Удивительный мир органической химии краткое содержание
Книга адресована старшеклассникам, учителям, а также тем, кто интересуется органической химией.
Удивительный мир органической химии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
В докладе ученого сквозила необычайная уверенность в теории, которую он излагал слушателям. Эта теория уже успела «поработать» на него: ученый мог не только предсказать существование неизвестных еще пока веществ, но и успел синтезировать некоторые из них.
А. М. Бутлеров сделал интересный вывод о том, что если свободные валентности углерода не насыщены водородом, то у углеродных атомов появляется возможность связываться между собой не только одной, но и двумя, и даже тремя химическими связями. Это было позже доказано строением этилена и ацетилена:

Понятие о химическом строении, высказанное А. М. Бутлеровым, позволило объяснить такое загадочное явление в органической химии, как изомерия.
Конечно, в своем докладе ученый сказал не все. Многое еще предстояло домыслить. Основные положения теории строения А. М. Бутлерова не были опубликованы в одной статье, книге или докладе. Они, как драгоценные зерна, были рассеяны во многих статьях, выступлениях, дискуссиях великого химика. Сегодня эти положения кажутся нам понятными и логичными, но тогда они казались одним химикам гениальными, другим — фантазией, а у третьих вызывали чувство откровенного неприятия и даже раздражения. Да и как можно было оставаться равнодушным, если идеи новой теории прямо противоречили всем предыдущим учениям? Теория А. М. Бутлерова перечеркивала выводы известных ученых-химиков, которые утверждали, что строение молекул познать нельзя.
Некоторые западные химики сознательно старались принизить и даже отрицать заслуги русского химика. Находились и такие, которые прямо обвиняли А. М. Бутлерова в попытке присвоить чужие идеи, якобы высказанные ранее другими химиками, например А. Кекуле и А. Купером. Эти химики действительно внесли определенный вклад в развитие органической химии, однако считать их основателями общей теории строения все же нельзя. Ведь самым главным вкладом А. М. Бутлерова, отличающим его труды от работ других химиков, было ясное и последовательное положение о взаимосвязи между химическим строением и свойствами органических соединений.
Создавая теорию строения, А. М. Бутлеров уже тогда предполагал возможность и даже необходимость установления пространственного строения органических веществ. Дело в том, что теория строения в то время еще не могла объяснить некоторые факты в органической химии, например особые случаи изомерии. Это касалось, прежде всего, оптической и геометрической изомерии. Исследования причин этих видов изомерии, исходя из теории химического строения органических соединений А. М. Бутлерова, привели впоследствии к созданию учения о пространственном строении молекул — стереохимии (от греч. стереос — пространственный). В 1874 г. голландский химик Якоб Гендрик Вант-Гофф (1852-1911) и французский химик Жак Ашиль Jle Бель (1847-1930) выдвинули идею, согласно которой четыре связи атома углерода направлены в пространстве к четырем углам тетраэдра (если представить, что сам углерод находится в его центре (см. рис. 9). В дальнейшем на основании теории пространственного расположения химиче-ских связей и теории химического строения А. М. Бутлерова была развита наука о трехмерной ориентации атомов в молекулах.
К концу 90-х гг. XIX в. бутлеровская теория стала господствующей в органической химии. Этому способствовали два обстоятельства. Во-первых, теория строения привела наконец-то все разрозненные факты в систему. Во-вторых, она смогла не только объяснить многие известные факты, например явление изомерии, но и предсказать еще неизвестные.
Теория А. М. Бутлерова и сегодня остается фундаментом органической химии. Однако она не является чем-то незыблемым. Происходит постоянное совершенствование многих положений теории, их обогащение новыми фактами. И все же основные, главные положения бутлеровской теории сохранили и будут сохранять свою силу.
1.7. Как нарисовать молекулу
Можно ли нарисовать молекулу на бумаге? Такой вопрос задавали химики еще в середине XIX в. Они пытались это сделать, но такие попытки, конечно, были безуспешными.
Теперь нам понятны причины этих неудач. Для того чтобы изобразить молекулу на листке бумаги, необходимо было знать строение органических веществ.
Для решения этой проблемы много сделали химики, развивая учение о валентности химических элементов. Напомним, что валентность химического элемента — это свойство его атомов присоединять определенное число атомов других элементов. Поскольку углерод является основой всех органических соединений, то установление его четырехвалентности было важным моментом для объяснения строения этих веществ. Как известно, идеи о четырехвалентности атома углерода высказал А. Купер еще в 1858 г. При этом он считал, что углеродные атомы могут соединяться друг с другом (правда, эта мысль была уже не новой; ее высказал Фридрих Рохледер еще в 1852 г.). Однако этого было, конечно, недостаточно. Для построения даже простейшей (эмпирической) формулы химического вещества необходимо было знать его качественный и количественный состав. Известно, что многие органические соединения состоят из углерода, водорода и кислорода. Определив содержание этих элементов, уже можно было установить эмпирическую формулу соединения. Правда, в отличие от веществ неорганических, с органическими соединениями дело обстояло сложнее, так как последние отличались большим содержанием атомов в молекуле. Например, долго велись дискуссии по поводу эмпирической формулы уксусной кислоты, которая оказалась не такой уж и сложной (С 2Н 4O 2). Но как бы там ни было, к тому времени удалось установить формулы для 2-3 десятков органических соединений, в том числе и для некоторых простых сахаров.
Однако эмпирические формулы, показывающие, какие элементы и в каком количестве входят в состав органического вещества, мало говорят о его строении. Для этого нужны другие формулы — формулы строения. Такие формулы называют структурными формулами.
Согласно представлениям А. Кекуле, А. Купера и А. М. Бутлерова, углеродные атомы могут соединяться друг с другом с помощью одной или нескольких из четырех своих валентных связей, образуя длинные углеродные цепи — прямые или разветвленные. Поскольку у каждого атома углерода имеются четыре валентные связи, а у каждого атома водорода — только одна такая связь, можно изобразить три формулы простейших предельных углеводородов — метана СН 4, этана С 2Н 6и пропана С 3Н 8следующим образом:
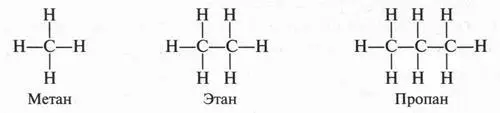
В молекуле метана атомы водорода связаны с атомом углерода, а не друг с другом. Это и понятно. Если допустить, что водородные атомы соединены не с углеродным атомом, а между собой, то тогда они, исчерпав на это по единственной валентности, не смогли бы соединиться с атомом углерода. В результате образовались бы две молекулы водорода, а не молекула метана. Рассмотрим молекулу этана. В этой молекуле два атома углерода связаны между собой, а каждый из них — с тремя водородными атомами. Возможно ли другое соединение атомов? Нет. В противном случае мы должны допустить существование таких структур:
Читать дальшеИнтервал:
Закладка:









