Александр Артеменко - Удивительный мир органической химии
- Название:Удивительный мир органической химии
- Автор:
- Жанр:
- Издательство:Дрофа
- Год:2005
- Город:Москва
- ISBN:5-7107-9540-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Артеменко - Удивительный мир органической химии краткое содержание
Книга адресована старшеклассникам, учителям, а также тем, кто интересуется органической химией.
Удивительный мир органической химии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Атом, являясь носителем свойств элемента, как известно, состоит из положительно заряженного ядра, в котором сосредоточена почти вся масса атома, и отрицательно заряженных частиц — электронов, окружающих ядро. В состав ядра входят положительно заряженные частицы — протоны и нейтральные частицы — нейтроны. Суммарное число этих частиц равно массовому числу атома (ядра). Поэтому, хотя ядро очень мало (одна стотысячная диаметра атома), оно ответственно за всю «тяжесть» атома. Электронов в атоме столько, сколько протонов в ядре. Поэтому атом — нейтральная частица.
Теперь рассмотрим атом углерода. Заряд его ядра равен +6. Это означает, что у атома углерода должно быть 6 электронов, которые располагаются на двух электронных оболочках (слоях). На ближней к ядру оболочке ( К -оболочка) находятся два электрона, а на наружной оболочке ( L -оболочка) — четыре (рис. 3). Два электрона на K -оболочке не принимают участия в химических реакциях, так как прочно связаны со «своим» ядром. Электроны, которые расположены на L -оболочке, очень активны и от них зависит химическое поведение атома углерода. Но таких «активных» электронов у атома углерода всего четыре, т. е. его наружная электронная оболочка заполнена лишь наполовину (по сравнению с внешними электронными оболочками инертных газов). В этом и состоит одна из особенностей атома углерода. Может ли этот атом образовать устойчивую электронную оболочку из восьми (или двух) электронов? Казалось бы, все очень просто: он должен отдать или принять четыре электрона. Однако это сделать очень непросто.
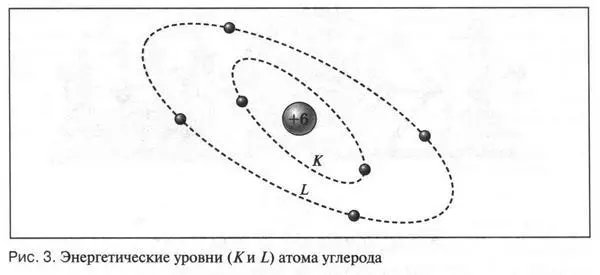
Допустим, что атом углерода отдал один электрон. В этом случае шесть положительных зарядов ядра начнут преобладать над оставшимися пятью электронами (ведь атом должен оставаться электронейтральным!). Отдать второй электрон еще труднее. Говорить же об отрыве большого числа электронов от ядра вообще не приходится. Слишком сильным будет притяжение оставшихся электронов к ядру. А могут ли электроны, наоборот, присоединяться к ядру? Нет, не могут. Дело в том, что чем больше электронов будет находиться на внешней оболочке, тем большим будет избыточный отрицательный заряд. А поскольку одноименные заряды отталкиваются, то присоединение новых электронов (до полного октета, т. е. восьми) будет все больше и больше затруднено. Вот почему атом углерода только в исключительных случаях образует ионы.
Электроны разных оболочек различаются энергиями. Поэтому электронные оболочки называют еще энергетическими уровнями. Их обозначают или большими латинскими буквами ( К , L, М, N и т. д.), или арабскими цифрами (1, 2, 3, 4 и т. д.). Чем дальше от ядра находятся энергетические уровни, тем большей энергией обладают их электроны. При этом энергия электронов одного и того же энергетического уровня примерно одинакова. Почему примерно, а не одинакова? Потому что электроны одного энергетического уровня образуют еще и энергетические подуровни. На одном подуровне размещены электроны с одинаковой энергией, а на разных — с несколько отличающейся. Сколько же подуровней содержится на каждом уровне? Это легко запомнить: число подуровней равно номеру энергетического уровня. Например, первый энергетический уровень содержит один подуровень, второй — два, третий — три и т. д. Поскольку речь идет об атоме углерода, то его первый энергетический уровень приравнивается к одному подуровню, а второй состоит из двух подуровней. Это можно изобразить в виде такой схемы:
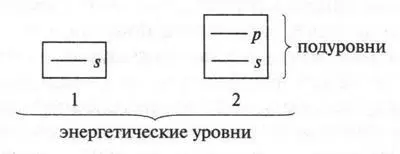
Разные энергетические уровни условно обозначают разными по величине квадратами (меньше энергии — меньше квадрат, больше энергии — больше квадрат). Внутри квадратов в виде черточек расположены подуровни, которые обозначены латинскими буквами — s, р. Черточки расположены одна выше другой. Чем выше черточка, тем большей энергией обладают электроны, «населяющие» данный подуровень.
Нам остается выяснить, какие электроны и сколько их размещается на энергетических подуровнях атома углерода. Но вначале поговорим о самой загадочной частице — электроне.
2.2. «Жилище» для электронов — орбиталь
Электрон нельзя сравнить ни с чем, что окружает нас в этом мире. Сколько бы ни было электронов в атоме, ни один из них не повторяет по свойствам другой. Каждый электрон индивидуален. Но у них есть и сходные свойства. Главное из них — все электроны находятся в постоянном движении. Если бы электрон был неподвижен, он тотчас бы упал на ядро, так как противоположные заряды, которые несут электрон и ядро, взаимно притягиваются. Однако электроны не вращаются вокруг ядра, как Земля вокруг Солнца, поэтому плоских электронных орбит в атоме не существует. Движение в атоме очень сложное и подчиняется особым законам (законам квантовой механики). Но самое удивительное то, что электрон совмещает в себе, казалось бы, несовместимое. С одной стороны, электрон обладает свойствами частицы (с массой 9,109 • 10 -31кг), а с другой — свойствами волны (с длиной около 10 -10м). Так, попадая на пластинку с фотослоем, электрон вызывает почернение в одном определенном месте ее поверхности (в одном «зерне» фотослоя). Это — доказательство того, что электрон является частицей. В то же время электроны способны огибать встречающиеся на пути преграды и препятствия. Но это же свойство характерно и для волн! Один ученый-физик пошутил по этому поводу: «По понедельникам, средам и пятницам электрон ведет себя как волна, а по вторникам, четвергам и субботам — как частица, в воскресенье же он отдыхает...»
Двойственная природа («частица-волна») электрона приводит к тому, что для него не существует такого понятия, как траектория его движения. Нельзя одновременно установить, где находится электрон в данный момент и в каком направлении он движется. Другими словами, электрон «мечется» не по какой-то определенной траектории, а, «прыгая» с колоссальной скоростью, может находиться в любой части околоядерного пространства — то ближе, то дальше от ядра. В этом случае можно говорить только о возможности (вероятности) пребывания электрона в том или другом положении относительно ядра атома. Электрон как бы «размазан» в этом пространстве, и все его траектории движения сливаются в сплошное облако (рис. 4). При этом плотность такого облака убывает с увеличением расстояния от ядра. Если изобразить вероятность нахождения электрона в какой-то момент на определенном расстоянии от ядра в виде точек, то получим такую картину: где-то таких точек будет мало и там электрон будет довольно редко, а где-то этих точек будет очень много и электрон там находится чаще. Такое околоядерное пространство, в котором электрон находится большее время, называется электронным облаком или электронной орбиталью.
Читать дальшеИнтервал:
Закладка:









